Изготовляем электролит своими руками — Auto-Self.ru
На сегодняшний день рынок аккумуляторных батарей предлагает автолюбителям массу различных вариантов аккумуляторов. Главный критерий, по которому выбираются батареи – долгий срок службы электролита внутри. Можно приобрести сухозаряженные АКБ и потом сделать электролит самостоятельно, либо купить уже готовый вариант, залитый в заводских условиях. После покупки обслуживание можно делать либо своими руками, либо в специальных сервисах. Поэтому важно знать, как готовить электролит своими руками , чтобы в случае необходимости вы были вооружены к самостоятельному обслуживанию АКБ.
Подготовка к процессу
Перед тем как начинать приготовление электролита, нужно подготовить все необходимые для этого вещи. Вам потребуются такие элементы процесса:
- Специальная эбонитовая или керамическая посуда, объемом не менее 4 литров. Важно, чтобы посуда была стойкая к кислоте.
- Инструмент для размешивания щелочных материалов.

- Дистиллированная вода.
- Ареометр.
- Серная кислота. Обязательно требуется использовать специальную аккумуляторную серную кислоту.
Приготовление сопровождается соблюдением техники безопасности, вам потребуются:
- Резиновые перчатки.
- Халат или плотный фартук.
- Защитные очки для глаз.
- Нашатырная и борная кислота.
Только имея все необходимое, допускается своими руками готовить электролит.
Приготовление жидкости для АКБ
По правилам техники безопасности, сделать электролит можно будет только после того, как выполняющий все операции человек будет должным образом защищен всеми доступными средствами защиты. Перед тем как приступать к делу, еще раз в голове прокрутите последовательность действий, чтобы ничего не перепутать, проверьте под рукой ли ареометр.
Итак, начинать нужно с промывки всей используемой посуды дистиллированной водой, а после этого посуда обязательно должна высохнуть. Также нужно сказать, что между приготовлением электролита с нуля и доливкой в аккумулятор есть существенная разница. Когда у вас ареометр показал упавшую плотность в АКБ, то вы должны долить внутрь только воды, ни в коем случае не кислоты. Когда же вы готовите электролит с нуля, то в емкость сперва наливается вода, а потом кислота. Эти два момента ни в коем случае нельзя путать – это крайне важно для того, чтобы правильно приготовить электролит своими руками.
Все дело в том, что серная кислота продается концентрированная, из расчета на емкость стандартных видов аккумуляторов. При соприкосновении с водой начинается химическая реакция, при этом если перепутать ингредиенты, то реакция начнет сопровождаться всплесками и значительным увеличением температуры. Во время изготовления жидкость нужно помешивать с помощью кислотоустойчивой палочки.
Критерии изготовления
При готовке электролита для щелочных аккумуляторов, нужно в руководстве по эксплуатации обязательно посмотреть рекомендуемое значение плотности. В большинстве случаев плотность привязывается к +25°С – это позволит исключить вероятность замерзания и повреждения аккумулятора вследствие этого. Если же у вас температура отлична от этого показателя, то используя ареометр, вам своими руками нужно будет увеличить плотность. Это делается в пропорции 0.035 единиц на 5 градусов. Соответственно, если температура ниже, то плотность понижается по такому же принципу. Также обязательно для щелочных аккумуляторов нужно измерить изначальную плотность серной кислоты. В концентрированном варианте она равна 1.83 г/см
Поделитесь с друзьями в соц.сетях:
Google+
Telegram
Vkontakte
Источник тока из алюминия своими руками

Приветствую, Самоделкины!
Из года в год добыча нефти становится все более сложной и топливо, получаемое из нее, становится все более дорогим. В странах евросоюза так вообще грозятся перестать выпускать бензиновые двигатели, хотят заменить весь транспорт на электромобили. Но вот литиевые батареи до сих пор далеко не идеальные и к слову, идеальными становиться совсем не торопятся. В лучшем случае на одном заряде литиевой батареи получится преодолеть дистанцию максимум в 700 км, после чего придется заряжать аккумулятор примерно неделю, а если использовать для зарядки обыкновенную розетку, то это вообще займет просто уйму времени. И вы только представьте, что произойдет, если все начнут постоянно заряжать свои электромобили, какие будут огромные нагрузки на электросеть и как сильно будет просаживаться напряжение. В общем, будущее литиевых аккумуляторов пока видится довольно туманно и с каждым годом все больше и больше исследований посвящается поискам новых вариантов аккумуляторных батарей.
Как известно, самым энергоемким металлом является алюминий. Уже в наше время на некоторых опытных образцах алюминиевых батарей можно проехать без подзарядки порядка 2000 км, причем перезарядка аккумуляторных батарей данного типа происходит всего за 15 минут, после чего можно ехать дальше еще около 2000 км.
Перезарядка алюминиевых батарей отличается от зарядки аккумуляторов на основе лития. Но тем не менее в ней нет ничего сложного, просто нужно вставить новый алюминий, вылить электролит и налить новый электролит, все — по сути, то же самое, что и бензиновый автомобиль, только это уже электромобиль, и нет никаких нагрузок на электросети. К тому же не нужно плодить огромное количество розеток с проводами с огромным сечением, чтобы все эти электромобили зарядить.
Чтобы такая батарея начала работать понадобятся 2 электрода: один естественно из алюминия, а второй — из графита. Оба эти электрода находятся в растворе электролита.

В качестве электролита можно использовать поваренную соль (NaCl), но с ней можно поднять напряжение примерно до 0,7В. Щелочным электролитом (NaOH) напряжение можно поднять уже больше, примерно до 1В.

Первую проблему с выпадением осадка гидроксида алюминия можно избавиться простым увеличением емкости, куда будет оседать отработанный продукт, а вот от второй проблемы может помочь деполяризующая масса на основе оксида марганца, который в процессе работы будет превращаться в гидроксид марганца.

По сути мы получили обыкновенную щелочную батарейку, но только очень большую. Но возникает новая проблема. Дело в том, что оксид марганца тоже расходуются и его тоже придется менять. А нам необходимо добиться чтобы расходовался только алюминий. Для этого придется взять кислород из окружающего воздуха. Вот тут-то и начинается алюминий-воздушная батарея. Одну из стенок просто нужно заменить газопроницаемой мембраной, а графитовый электрод нужно заменить смесью графита и оксида марганца с наночастицами платины или серебра.

Оксид марганца с наночастицами благородного металла не вступает в реакцию, а действуют как катализатор, благодаря чему водород из электролита окисляется кислородом находящемся в воздухе.

Технологиями получения оксида марганца с включениями наночастиц серебра в принципе не сложна и его можно попробовать получить в кустарных условиях. Но в данной статье мы разберем как сделать максимально бюджетный вариант батареи, получающей энергию из алюминия. Дальнейшая инструкция взята с YouTube канала «Огненное ТВ». Более подробно
Максимально бюджетный вариант графита — это летние контактные вставки для троллейбусов. Их можно найти абсолютно бесплатно на конечных троллейбусных остановках, а можно и купить, стоят они не дорога, автор нашёл их в продаже по 22 рубля за штуку.

Далее нам потребуется щелочь. Вот такое средство для чистки труб в своем составе содержит стопроцентную натриевую щелочь.

Для запуска реакции щёлочи нам понадобится совсем чуть-чуть, будет достаточно 1г щёлочи на 0,5л воды.
Первым делом давайте проверим действительно ли в данной батареи нужно использовать графитовый электрод. Для опыта возьмем вот такой вот электрод из нержавеющей стали.

Теперь помещаем алюминиевую пластину и электрод из нержавейки в щелочь, подключаем мультиметр и смотрим сколько вольт получится.

Как видим, получилось примерно 1,4В. Теперь давайте проверим ток короткого замыкания.
Ток КЗ получился в районе 20мА. Какие можно сделать выводы: теоретически в экстремальных условиях возможно собрать батарею из нержавеющих кружек и алюминиевой фольги.

Следующий у нас будет медный электрод, выполненный из электротехнической меди.

Как можем наблюдать напряжение получилось чуть выше чем 1,4В, а вот ток короткого замыкания поначалу было высоким, но потом начал достаточно быстро проседать и медь к тому же начала покрываться темным налетом, скорее всего такой эффект вызвали примеси в воде, так как воду для этого эксперимента автор взял водопроводную, из-под крана.

Теперь погружаем в раствор электролита графитовый электрод.


С данным электродом получилось напряжение 1,3В, ток короткого замыкания остановился в районе 17мА. На первый взгляд кажется, что электрод из нержавеющей стали более эффективен, но площадь поверхности нержавеющего электрода больше, так что пока неизвестно что лучше графит или нержавейка.
Так как графит имеет достаточно большое сопротивление, нужно с ним как-то бороться. Необходимо изготовить электроды из хорошо проводящего ток материала, а графит должен быть только на его поверхности. Было решено просверлить графит насквозь, и в получившихся отверстиях нарезать резьбу под болты м6.
В итоге получился стальной электрод с графитовой оболочкой.

Сопротивление не просверленного графита составляет примерно 4.5Ом, а просверленного графита примерно 1,7 Ома.


На лицо уменьшение сопротивления, а, следовательно — эффективность конструкции возрастет. В дальнейших экспериментах будем использовать дистиллированную воду.
Первый эксперимент с электролитом, в котором 4г щелочи на 1л воды.


Ток короткого замыкания получился 150мА. Следующий электролит имеет концентрацию 6г щелочи на 1 литр. Ну и так далее, каждый раз будем увеличивать концентрацию на 2г пока не дойдем до концентрации, при которой ток не будет расти.


Даже несмотря на то, что у такая простая батарея обладает не большой отдачей по току, но зато такая батарея может работать очень долго, а в качестве электродов можно использовать любой алюминий, который легко переплавить в электроды любой формы, например, алюминиевые банки из-под различных алкогольных и безалкогольных напитков, фольга от шоколада и т.п.
В итоге, после всех проделанных экспериментах с различной концентрацией электролита, становится понятно, что при такой конструкции батареи не имеет смысла добавлять более 12г щелочи на 1 литр воды, то есть у нас получается примерно 1% раствор.

Затем автор собрал еще одну обойму, состоящую из 3-ех электродов.


Две батареи дают более высокое напряжение и потери меньше, поэтому и результат лучше.
А теперь возьмем ведро электролита, большой кусок алюминия и 2 электрода из нержавейки.
В ведре электролит концентрации 10г/1л. Пиковый ток 1,3А, просел он до 520мА. При всей огромной площади нержавейки с графитом она не сравнилась, потому что с графитом получилось 600мА. Кстати, в ходе реакции выделяется водород, который также можно собирать и использовать как источник энергии. Короче, есть куда расти. На этом пока все. Благодарю за внимание. До новых встреч!
Источник
 Доставка новых самоделок на почту
Доставка новых самоделок на почтуПолучайте на почту подборку новых самоделок. Никакого спама, только полезные идеи!
*Заполняя форму вы соглашаетесь на обработку персональных данных
Становитесь автором сайта, публикуйте собственные статьи, описания самоделок с оплатой за текст. Подробнее здесь.как сделать для щелочных аккумуляторов
На сегодняшний день рынок аккумуляторных батарей предлагает автолюбителям массу различных вариантов аккумуляторов. Главный критерий, по которому выбираются батареи – долгий срок службы электролита внутри. Можно приобрести сухозаряженные АКБ и потом сделать электролит самостоятельно, либо купить уже готовый вариант, залитый в заводских условиях. После покупки обслуживание можно делать либо своими руками, либо в специальных сервисах. Поэтому важно знать, как готовить электролит своими руками , чтобы в случае необходимости вы были вооружены к самостоятельному обслуживанию АКБ.
Подготовка к процессу
Перед тем как начинать приготовление электролита, нужно подготовить все необходимые для этого вещи. Вам потребуются такие элементы процесса:
- Специальная эбонитовая или керамическая посуда, объемом не менее 4 литров. Важно, чтобы посуда была стойкая к кислоте.
- Инструмент для размешивания щелочных материалов. Так как делать это вы будете своими руками, то инструмент также должен тоже быть кислотоустойчивым.
- Дистиллированная вода.
- Ареометр.
- Серная кислота. Обязательно требуется использовать специальную аккумуляторную серную кислоту.
Приготовление сопровождается соблюдением техники безопасности, вам потребуются:
- Резиновые перчатки.
- Халат или плотный фартук.
- Защитные очки для глаз.
- Нашатырная и борная кислота.
Только имея все необходимое, допускается своими руками готовить электролит.
Приготовление жидкости для АКБ
По правилам техники безопасности, сделать электролит можно будет только после того, как выполняющий все операции человек будет должным образом защищен всеми доступными средствами защиты. Перед тем как приступать к делу, еще раз в голове прокрутите последовательность действий, чтобы ничего не перепутать, проверьте под рукой ли ареометр.Итак, начинать нужно с промывки всей используемой посуды дистиллированной водой, а после этого посуда обязательно должна высохнуть. Также нужно сказать, что между приготовлением электролита с нуля и доливкой в аккумулятор есть существенная разница. Когда у вас ареометр показал упавшую плотность в АКБ, то вы должны долить внутрь только воды, ни в коем случае не кислоты. Когда же вы готовите электролит с нуля, то в емкость сперва наливается вода, а потом кислота. Эти два момента ни в коем случае нельзя путать – это крайне важно для того, чтобы правильно приготовить электролит своими руками.
Все дело в том, что серная кислота продается концентрированная, из расчета на емкость стандартных видов аккумуляторов. При соприкосновении с водой начинается химическая реакция, при этом если перепутать ингредиенты, то реакция начнет сопровождаться всплесками и значительным увеличением температуры. Во время изготовления жидкость нужно помешивать с помощью кислотоустойчивой палочки.
Критерии изготовления
При готовке электролита для щелочных аккумуляторов, нужно в руководстве по эксплуатации обязательно посмотреть рекомендуемое значение плотности. В большинстве случаев плотность привязывается к +25°С – это позволит исключить вероятность замерзания и повреждения аккумулятора вследствие этого. Если же у вас температура отлична от этого показателя, то используя ареометр, вам своими руками нужно будет увеличить плотность. Это делается в пропорции 0.035 единиц на 5 градусов. Соответственно, если температура ниже, то плотность понижается по такому же принципу. Также обязательно для щелочных аккумуляторов нужно измерить изначальную плотность серной кислоты. В концентрированном варианте она равна 1.83 г/см3, если вы покупаете готовый электролит, то плотность 1.43 г/см3.
Как сделать электролит для аккумулятора своими руками?
Современные автомобильные аккумуляторы попадают в продажу полностью подготовленными для дальнейшей установки и эксплуатации под капотом. То есть, внутри корпуса уже залит электролит, и подготавливать смесь и заправлять её банки совершенно ненужно. Но, в процессе эксплуатации могут возникнуть разные технические проблемы, и хотя бы теоретически знать, как приготовить электролит самостоятельно просто необходимо уметь.
Электролит, это специальная жидкость, которая в сочетании со свинцовыми пластинами покрытыми активным слоем путём химического процесса помогает накапливать и отдавать электрический ток.
Из чего состоит электролит
Опытные сотрудники АКУМ5 помогут разобраться с этим вопросом так, чтобы не осталось тёмных пятен, и любой водитель автомобиля мог самостоятельно, при необходимости, сделать нужное количество кислоты для своего АКБ. Если совсем простыми словами, то это серная кислота, смешанная с дистиллированной водой в пропорции 30% к 70%.
Более точная концентрация серной кислоты зависит от региона использования источника питания. В тёплых странах будет вполне достаточно плотности жидкости в 1,23 г/см3. В самых холодных странах Европы заливают электролит плотностью 1.29 г/см3. Если выбрать неправильную концентрацию, это гарантировано приведёт к трагическим последствиям. Во время сильных морозов вода начнёт замерзать и разрушать пластины и активную массу.
Важно: если вы действительно на практике заходите поработать с серной кислотой, необходимо как минимум обзавестись соответствующей защитой. Плотные резиновые перчатки, одежда из натуральных материалов и защитные очки с достаточно большими стёклами.
Какие ингредиенты необходимо подготовить
Итак, необходимо купить и подготовить следующие важные составляющие будущего электролита для свинцово-кислотных аккумуляторов:
— фарфоровая посуда на несколько литров;
— дистиллированная вода;
— серная кислота, плотность которой не ниже показателя 1.83 г/см3.
Поставьте всё это на надёжный стол в хорошо проветриваемой комнате, а лучше на свежем воздухе. Обязательно наденьте необходимую защиту, и можно приступать к смешиванию.

Важно: не стоит использовать в качестве смешивания стекло. Скорее всего, оно не выдержит повышения температуры и может банально лопнуть. Последствия вытекшей кислоты будут достаточно печальными.
В ёмкость необходимо сначала налить воду, и только потом тонкой струйкой влить порцию кислоты. Практически мгновенно начнётся химическая реакция, которая приведёт к выделению большого количества тепла. Будут выделяться и опасные газы в небольшой концентрации. Но, всё равно не стоит пренебрегать качественным проветриванием. Если у вас под рукой есть ареометр (специальный прибор для проверки плотности электролита), то добиться необходимой концентрации очень просто. Для Украины оптимальная концентрация для круглогодичной эксплуатации является показатель в 1,27 г/см3.
Важные мелочи
Многие могут подумать, что можно приготовить кислоту большей плотности, и не переживать за зимнюю эксплуатацию, даже если мороз будет опускаться до более низких температур, чем это принято для нашего региона. Особенно в моменты частичного разряда источника питания.
Это не стоит делать, так как повышенное количество серной кислоты очень негативно влияет на долговечность свинцовых электродов и активной массы.
Ошибка в тексте? Выделите и нажмите Ctrl+Enter!Теги: электролит для аккумулятора, приготовление электролита
Как приготовить электролит для АКБ
Непосредственно перед работой нужно приготовить резиновые перчатки, фартук или спецодежду, устойчивую к кислотам и защитные очки. Под рукой должны быть нашатырь или 5-10 % раствор кальцинированной соды для ослабления действия кислот и 10-процентная борная кислота для нейтрализации щелочи.

Материалы для приготовления
- 5-литровая емкость из керамики, полиэтилена, хлорвинила ли эбонита
- эбонитовая палка или из другого материала, не поддающегося действию кислот и щелочи
- опрокидывающаяся лейка
- приборы для определения температуры, плотности жидкости и уровня
- аккумуляторная батарея
- дистиллированная вода
- аккумуляторная серная кислота.
Перед работой все предметы, которые будут использоваться, требуется промыть дистиллированной водой и высушить их.
Советы по приготовлению
Плотность электролита должна отвечать внешним температурным режимам, при которых будет работать батарея, включая сильные морозы.
Плотность электролита должна быть указана в инструкции к АКБ и ее нужно довести до 25 градусов со знаком плюс, что в дальнейшем исключит замерзание и выход из строя аккумулятора.
Далее потребуется определить плотность серной кислоты для приготовления электролита, по правилам она равняется 1,83 г/см3.
Затем нужно определиться с количеством дистиллированной воды, для этого используют специальные таблицы.
Важно: при соединении воды и кислоты возникает реакция и на выходе количество вещества будет меньше, чем суммарное исходное количество ингредиентов.
Приготовление
Когда все приготовления окончены, можно приступать к смешиванию. В емкость наливается отмеренное количество воды, за ней следует серная кислота — начинается бурная реакция ингредиентов, при которой часто и возникают химические ожоги.
Полученную массу нужно остудить до 150-300 градусов и разлить в стеклянные бутылки. Всю тару для электролита следует маркировать с указанием срока изготовления и его плотности.
Несмотря на кажущуюся легкость приготовления электролита для АКБ, этот процесс крайне опасен для здоровья и в большинстве случаев оптимальным вариантом станет визит в сервисный центр по обслуживанию аккумуляторных батарей.
Смотреть все фото новости >>
Поделиться Сообщить об ошибкеВыделите ее и нажмите Ctrl + Enter
 Просмотров: 3212 | Источник: car.ru | Автор: Плотников Д. А.
Просмотров: 3212 | Источник: car.ru | Автор: Плотников Д. А.
Гальваника. Рецепт электролита и работа с блоком питания. Часть 2
Эта публикация является продолжением моей первой статьи по гальванике. Сегодня мы рассмотрим еще один рецепт электролита, а также работу с блоком питания.
Этот электролит я называю электролитом гладкого меднения. Методика его приготовления такая же, как любого сернокислого электролита и об этом я писала в предыдущей статье. Во всех моих рецептах количество серной кислоты указано в расчете на использование автомобильного аккумуляторного электролита.
Итак, рецепт:
- 200 г медного купороса;
- 140 -145 мл серной кислоты;
- 0,07 г тиомочевины;
- 0,07 г повареной соли (мелкой «экстра»).
Плюсы данного электролита:
1) Хорошее, ровное, досточно блестящее покрытие.
2) Хорошая скорость закрытия и наращивания меди (экономит элетричество).
3) Отлично поддается любой полировке.
Минусы:
1) Достаточно чувствителен к силе тока.
2) Покрытие не слишком пластично, при попытке изменить форму может дать трещины.
При достаточном количестве тиомочевины и правильно выбранной силе тока должен получиться вот такой листик, гладкий, но имеющий на поверхности тонкую матовую пленку.

Пленка быстро убирается любой полировальной пастой

Если тиомочевины в электролите недостаточно — мы можем получить вот такую интересную мелкокрупитчатую поверхность изделия. Она чуть более блестящая, чем при матовом меднении и лучше поддается полировке. При патинировке на такой поверхности можно добиться интересного слегка перламутрового эффекта. Фото до и после полировки.


А теперь поговорим о самом, пожалуй, важном — ТЕХНИКЕ БЕЗОПАСНОСТИ.
Любые работы с электролитом ОБЯЗАТЕЛЬНО, ВСЕГДА, БЕЗ ИСКЛЮЧЕНИЙ проводятся в перчатках, очках и фартуке. Сейчас буду пугать!
1. Перчатки — тонкие латексные. Буквально через несколько дней работы без перчаток начинают слоиться ногти и сглаживаться папиллярные линии на подушечках пальцев из за чего пальцы теряют чувствительность. Нам, рукодельницам, это надо?
2. Очки — строительные, плотно прилегающие к лицу. Поверьте, не раз и не два у вас будет случаться ПЛЮХ!. Кошка под ногу подвернулась, проволочка оборвалась… Химический ожог роговицы — не самое приятное переживание в жизни.
3. Фартук — прорезиненный или клеенчатый, покупается в магазине спецодежды. Электролит очень быстро прожигает дыры в одежде. За первые 2 месяца гальванических работ (еще без фартука) я потратила на домашнюю одежду больше, чем за 10 предыдущих лет. Не думайте, что вам удасться избежать случайного попадания электролита на одежду!
При смешивании электролита очень желательно надеть респиратор или хотя бы влажную марлевую повязку во избежание попадания пыли медного купороса в дыхательные пути.
Гальваническую ванну лучше всего поставить на большой лист пластика. Рядом обязательно должна быть миска с водой. Вынимаем изделие, прополаскиваем в воде и прямо так, в миске, несем к раковине. Не стоит капать кислотой на ламинат.
Даже небольшая ванночка (1-2 л) должна находиться в хорошо проветриваемом помещении. Подоконник отлично подойдет.
Пожалуйста, всегда будьте внимательны и осторожны!!!! Помните, что вы работаете с опасными реактивами!!!
Ну, и в завершение, несколько слов о работе с блоком питания. Иногда люди жалуются, что изготовив по моему рецепту электролит электрохимической полировки, не получают блестящего изделия. Или что при использовании электролита матового меднения структура меди на поверхности получается крупитчатой и осыпается. Это все — ошибки в работе с блоком питания.
Самое главное — у нас должен быть блок питания с вольтметром и амперметром.
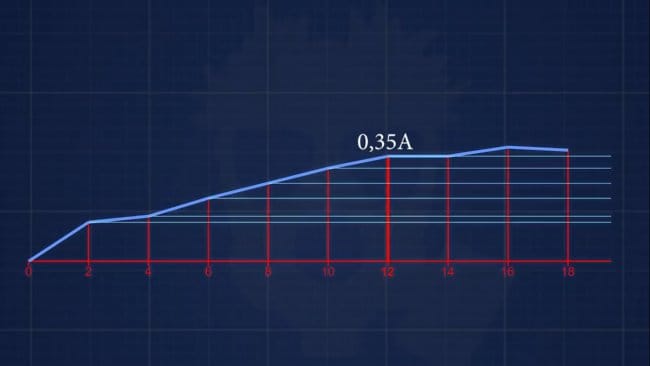
Итак, начинаем: сначала мы наш листочек покрыли графитовым лаком в 3 слоя (не экономьте на лаке) и обратили внимание на то, что проволочная намотка на черешке листа тоже покрыта лаком.
Погружаем листочек в ванну и выставляем на БП 0,8-0,9 вольт. Ждем пока на амперметре на появится 0.13-0,15 Ампер и повышаем вольтаж до 1,1 Вольт. Опять ждем, пока на амперметре не покажется 0,35 А. Теперь повышаем вольтаж до рабочей величины.
А вот эту саму рабочую величину мы определяем эмпирически. Например, на достаточно крупный березовый лист, опущенный в электролит гладкого меднения нужно подать около 1,6 Вольт.
За полностью закрытым листом внимательно следим.
Изделие блестящее по краям, но матовое в центре — прибавить силу тока. Наоборот: изделие, блестящее в центре, но матовое по краям — силу тока убавить.
При чрезмерной силе тока изделие начинает «пригорать» по краям. На кончиках листьев возникают утолщения и наплывы меди.

Можно использовать этот эффект в декоративных целях, например при изготовлении шапочек для бусин, меднении кристаллов или лэмпворка и т.д. Можно, добившись нужного эффекта, убавить силу тока, чтобы эти наплывы покрылись слоем гладкой меди, для дальнейшей полировки.
А теперь скажите мне, пожалуйста, какая тема вас больше всего интересует (чтобы я знала, о чем писать следующую статью):
1) Восстановление электролита.
2) Полировка и химическое оксидирование.
3) Электрохимическое оксидирование.
Как восстановить автомобильный аккумулятор пищевой содой

Привет друзья! Сегодня я хочу рассказать вам ещё один простой действенный способ, как продлить срок службы своей старой аккумуляторной батарее. Все мы прекрасно знаем, что кислотно-свинцовый аккумулятор вещь не вечная. И даже если бережно следить на ним, рано или поздно он все равно начнет выходит из строя. Причиной тому — сульфатация пластин, в результате которой батарея теряет свою емкость и уже не способна выполнять заданные функции.
Хочу уточнить, что метода описанный ниже подходит только для засульфатированных аккумуляторов. Он не подходит для батарей с замкнутыми или вздутыми банками, с осыпанными пластинами, и т.п.
Явные признаки сульфатации пластин
Самым явным признаком является то, что аккумулятор не держит нагрузку. То есть, при замерах напряжения на клеммах вольтметр показывает полностью заряженную батарею, а при подключении нагрузки напряжение значительно проседает.
Вторым признаком является быстрый саморазряд. К примеру, вы не пользовались машиной дня 3. Приходите в гараж и пытаетесь завести. А аккумулятор сильно разряжен, что даже электроника не показывает свои значения.

Все эти явления не происходят сразу, а приходят постепенно, обычно через 3-5 лет эксплуатации батареи.
Восстановление аккумулятора автомобиля
Первым делом необходимо замерить начальное напряжение.

Далее проведем тест нагрузочной вилкой.

Я уже давно заметил увеличение саморазряда, поэтому сегодня она в обще разрядилась.
Не лишним будет проверить плотность электролита.

После того как батарея диагностирована и диагноз поставлен, переходим к восстановлению.
Ареометром сливаем сверху электролит насколько это возможно. Как видите, его цвет темный.

Теперь переворачиваем батарею и сливаем остатки в ведро. Это нужно делать особо осторожно и поворачивать корпус при сливе, чтобы ряд отверстий банок был горизонтален. Это нужно делать для того, чтобы выходящие струи электролита не замкнулись между собой.

Ну тут он совсем черный с большим количеством примесей.

Теперь необходимо найти емкость под аккумулятор. Я взял таз.

Используя проточную воду промоем все банки обычной водой. Заливаем доверху.

И сливаем.

Тем самым удалим остатки электролита и черный налет.
Далее берем пищевую соду, понадобится 400-500 грамм.

Разводим ее с 5 литрами обычной воды в канистре. И хорошенько перемешиваем.

Заливаем в каждый отсек до краев.

Все начинает бурлить. Доливаем в отсеки, где вылилось много раствора соды.

Подождем минут 15 пока реакция полностью завершится. И сливаем раствор.

Далее опять тщательно промываем все банки водопроводной водой.

Сливаем чуть дольше, чтобы лишней воды было минимум.

Слитый ранее электролит я буду заливать обратно — новый не нужен. Но для этого его необходимо отфильтровать. В роли фильтра использую синтетическую салфетку.

Размещаю ее в воронке.

И постепенно фильтрую весь ранее слитый электролит.

Затем постепенно заливаю его обратно по банкам.

Ждем пока выйдут пузырьки, доливаем при необходимости. Все протираем сверху насухо и закрываем крышки.

Замеряем напряжение. Оно без изменений практически.

Производим зарядку в течение часа.

Батарея заряжается. Ток при заряда тому свидетель. Напряжение выросло.

Тест нагрузочной вилкой это доказывает.

Теперь ставим батарею на полный цикл зарядки.

По прошествии времени аккумулятор зарядился и стал полностью работоспособен.
Немного теории процесса
В этом способе нет никакого фокуса, чистая химия. Дело в том, что сульфат расположенный на пластинах вступает в реакцию с раствором соды и вытравливается. Вот и все.
Конечно метода не дает 100% гарантии что батарея вернется к жизни, но все же попробовать можно.
Настоятельно рекомендую проводить все действия в защитных очках и перчатках!
Всем пока.

