Какая кислота используется в аккумуляторах?
Задумывались ли вы, действительно ли в батарее есть кислота и если да, то что это? Если вы не знаете, и вам интересно узнать немного больше о том, есть ли там кислота, что это такое и почему она подходит для используемых вами батарей, оставайтесь с нами.
Давайте начнем сначала…
Вы знаете, что наиболее популярными аккумуляторами, которыми оснащены почти 90% современных автомобилей, являются свинцово-кислотные.
Грубо говоря, такая батарея состоит из коробки, в которой в ячейки помещены пластины (обычно свинцовые), которые играют роль положительных и отрицательных электродов. Эти свинцовые пластины покрыты жидкостью, называемой электролитом.
Масса электролита в батарее состоит из кислоты и воды.
Какая кислота в батареях?
Кислота в автомобильном аккумуляторе — серная. Серная кислота (химически чистая серная кислота) представляет собой сильную двухосновную вязкую жидкость без цвета и запаха с плотностью 1,83213 г / см3.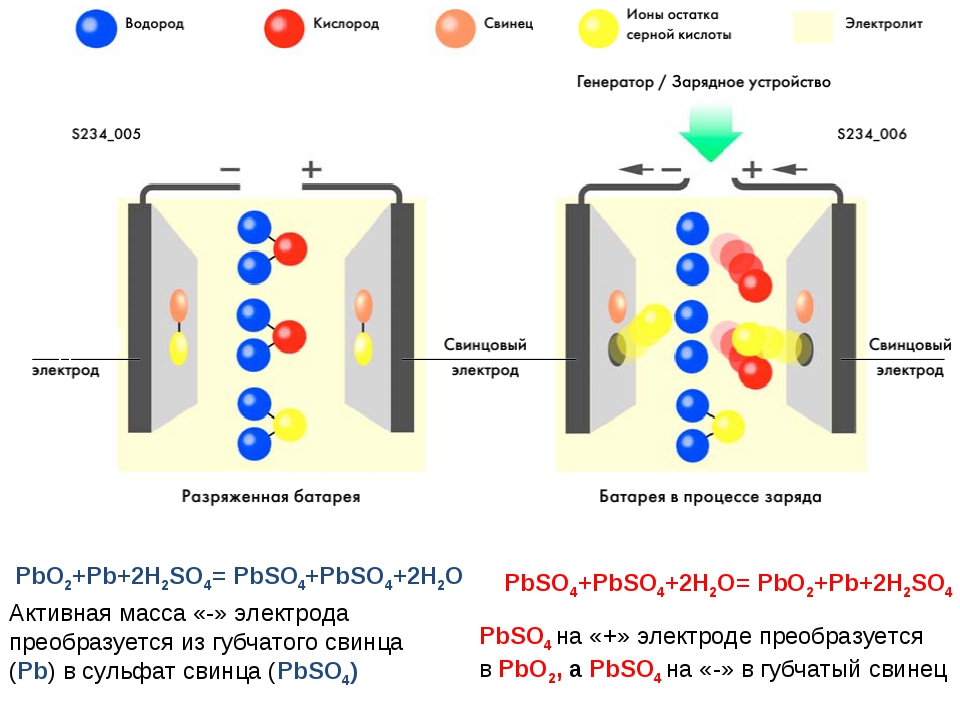
В вашей батарее кислота не концентрирована, а разбавляется водой (дистиллированная вода) в соотношении 70% воды и 30% h3SO4 (серная кислота).
Почему именно эта кислота используется в батареях?
Серная кислота является наиболее активной неорганической кислотой, которая взаимодействует практически со всеми металлами и их оксидами. Без этого разряжать и заряжать аккумулятор будет совершенно невозможно. Однако то, как будут происходить процессы зарядки и разрядки, зависит от количества дистиллированной воды, которой разбавляется кислота.
Или … Резюме, которое мы можем дать по вопросу о том, что за кислота находится в батареях, следующее:
В каждой свинцово-кислотной батарее есть серная кислота. Это (кислота) не в чистом, а в разбавленном виде и называется электролитом.
Этот электролит имеет определенную плотность и уровень, который со временем уменьшается, поэтому полезно регулярно проверять их и при необходимости увеличивать.
Как контролируется электролит в аккумуляторе?
Чтобы убедиться, что вы заботитесь о батарее своего автомобиля, рекомендуется регулярно проверять уровень и плотность рабочей жидкости (электролита).
Вы можете проверить уровень, используя маленький стеклянный стержень или прозрачную внешнюю часть простой ручки. Чтобы измерить уровень, вы должны открутить крышки батарейного отсека (эта проверка возможна, только если ваша батарея исправна) и погрузить стержень в электролит.
Если пластины полностью покрыты жидкостью и если это около 15 мм. над пластинами это означает, что уровень хороший. Если пластины не очень хорошо покрыты, вам нужно немного поднять уровень электролита.
Вы можете сделать это, покупая и добавляя дистиллированную воду. Залить очень легко (обычным способом), просто будьте осторожны, чтобы не переполнить батарею водой.
Используйте только дистиллированную воду, а не обычную воду. Обычная вода содержит примеси, которые не только значительно сократят срок службы батареи, но, если их будет достаточно, они могут напрямую отключить ее.
Для измерения плотности вам понадобится прибор, который называется ареометр. Это устройство обычно представляет собой стеклянную трубку с измерительной шкалой снаружи и ртутной трубкой внутри.
Если у вас есть ареометр, вам просто нужно опустить его на дно батареи, собрать электролит (устройство выполняет функцию пипетки) и посмотреть значения, которые он будет считывать. Нормальная плотность составляет 1,27 — 1,29 г / см3. и если ваше устройство показывает это значение, то все в порядке с плотностью, но если значения не то, вам, вероятно, придется увеличить плотность электролита.
Как увеличить плотность?
Если плотность составляет менее 1,27 г / см3, вам необходимо увеличить концентрацию серной кислоты. Для этого есть два варианта: либо купить готовый электролит, либо сделать свой собственный электролит.
Если вы остановитесь на втором варианте, вы должны быть очень, очень осторожны!
Перед началом работы наденьте резиновые перчатки и защитные очки и закрепите их хорошо. Выберите комнату с достаточной вентиляцией и не позволяйте детям приближаться, пока вы работаете.
Разбавление серной кислоты проводят в дистиллированной воде тонким потоком/струйкой. При заливании кислоты необходимо постоянно помешивать раствор стеклянной палочкой. Когда закончите, вы должны покрыть вещество полотенцем и дать ему остыть и отстояться на ночь.
При заливании кислоты необходимо постоянно помешивать раствор стеклянной палочкой. Когда закончите, вы должны покрыть вещество полотенцем и дать ему остыть и отстояться на ночь.
Крайне важно! Всегда сначала наливайте воду в миску, а затем добавляйте в нее кислоту. Если вы измените последовательность, вы получите тепловую реакцию и ожоги!
Если вы собираетесь эксплуатировать батарею в умеренном климате, соотношение кислота / вода должно составлять 0,36 л. кислоты на 1 литр дистиллированной воды, а если климат теплее, соотношение составляет 0,33 л. кислота на литр воды.
Совет. Хотя вы можете увеличить плотность рабочей жидкости самостоятельно, более разумным решением, особенно если ваша батарея старая, является ее простая замена на новую. Таким образом, вам не придется беспокоиться о правильном разбавлении кислоты, равно как и об ошибке при смешивании или заливке в аккумулятор.
Стало понятно, какая кислота в батареях, но опасно ли это?
Аккумуляторная кислота, хотя и разбавленная, является летучим и опасным веществом, которое не только загрязняет окружающую среду, но и может нанести серьезный вред здоровью человека. Вдыхание кислых паров может не только затруднить дыхание, но может вызвать побочные эффекты в легких и дыхательных путях.
Вдыхание кислых паров может не только затруднить дыхание, но может вызвать побочные эффекты в легких и дыхательных путях.
Длительное воздействие тумана или паров кислот аккумулятора может привести к таким заболеваниям, как катаракта верхних дыхательных путей, коррозия тканей, расстройства полости рта и другие.
Попав на кожу, эта кислота может вызвать покраснение, ожоги и многое другое. Если она попадет вам в глаза, это может привести к слепоте.
Помимо того, что аккумуляторная кислота опасна для здоровья, она также опасна для окружающей среды. Выброшенная старая батарея на свалке или разлитый электролит могут загрязнить грунтовые воды, что приведет к экологической катастрофе.
Поэтому рекомендации специалистов таковы:
- всегда проверяйте уровень и плотность электролита в вентилируемых помещениях;
- если на ваши руки попала аккумуляторная кислота, немедленно промойте их раствором воды и пищевой соды.
Примите необходимые меры предосторожности при работе с кислотой.
- если плотность электролита низкая, лучше обратиться в специализированную службу и не пытаться сделать это самостоятельно. Работа с серной кислотой без необходимой подготовки и знаний может не только навсегда повредить вашу батарею, но и повредить вашему здоровью;
- если у вас есть старая батарея, не выбрасывайте ее в мусорный бак, а ищите специализированные места захоронения отходов (или магазины, которые принимают старые батареи). Поскольку аккумуляторные батареи представляют собой опасные отходы, их утилизация на свалках или контейнерах может привести к экологической катастрофе. Со временем электролит в батарее будет разливаться и загрязнять почву и грунтовые воды.
Передав свою старую батарею в специально отведенные для этого места, вы не только позаботитесь об окружающей среде и здоровье других людей, но и поможете экономике, поскольку перезаряжаемые батареи можно переработать.
Мы надеемся, что внесли немного больше ясности в то, что за кислота находится в батареях и почему именно эта кислота используется. Мы также надеемся, что в следующий раз, когда вам придется заменить свою батарею на новую, вы позаботитесь о том, чтобы старая использовалась для переработки, чтобы она не загрязняла окружающую среду и не вредила здоровью людей.
Мы также надеемся, что в следующий раз, когда вам придется заменить свою батарею на новую, вы позаботитесь о том, чтобы старая использовалась для переработки, чтобы она не загрязняла окружающую среду и не вредила здоровью людей.
Вопросы и ответы:
Какая концентрация кислоты в аккумуляторе? В свинцово-кислотном аккумуляторе используется серная кислота. Она смешивается с дистиллированной водой. Процентное соотношение кислоты – 30-35% от объема электролита.
Для чего серная кислота в аккумуляторе? Заряжаясь, положительные пластины выделяют электроны, а минусовые принимают оксид свинца. При разряде происходит обратный процесс на фоне серной кислоты.
Что будет, если аккумуляторная кислота попадет на кожу? Если использовать электролит без средств защиты (перчатки, респиратор и очки), то при контакте кислоты с кожей образуется химический ожог.
ПОХОЖИЕ СТАТЬИ
Какая кислота в аккумуляторе автомобиля применяется в качестве электролита?
Состав электролита
Электролит, или серная кислота используется современной промышленностью для производства источников тока:
- в батареях;
- аккумуляторах;
- электрических конденсаторах.

В аккумуляторы заливается серная кислота разбавленного соотношения с водой — примерно 70% воды, 30% H 2 SO 4 . При ее отсутствии устройство не пригодно к работе. Особого внимания также заслуживает плотность жидкости, которую следует проверять и при необходимости увеличивать.
Контроль плотности
Составляющий компонент строения АКБ
Без наличия в аккумуляторе электролита не будет выполняться его основная функция, так как вещество является активатором заряда и разряда. В емкости устройства жидкости должно быть много, и, соответственно, вес аккумулятора не маленький. Примерное соотношение конструкции представляет до 20 % веса жидкости, до 25 % пластика и свинцовая составляющая достигает до 80 % веса. Плюсовые пластины состоят из диоксида свинца, минусовые монолитные пластины — чистый свинец. Пластины служат для сборки пакетов, способствующих накоплению заряда.
Следует отметить, что АКБ различается по моделям, и, в частности, модель 55 А/ч относится к одной из самых легких, какую можно встретить в легковых автомобилях достаточно часто. Ее вес не превышает 16 кг. Есть более компактные модели с незначительным весом, как, например, 40 А/ч и другие варианты.
Ее вес не превышает 16 кг. Есть более компактные модели с незначительным весом, как, например, 40 А/ч и другие варианты.
Нейтрализация электролита
Если аккумулятор вышел полностью из строя, его требуется грамотно. Но также в случае течи электролита из батареи необходимо узнать, чем нейтрализовать ее.
Бывают ситуации, когда при поломке аккумулятора может быть залита отдельная часть в месте его нахождения. Для этого необходимо вытащить батарею и провести очистку. Нейтрализация этого вещества из аккумулятора, как правило, проводится при помощи специального оборудования и применения технологий. Это важно с экономической и экологической точек зрения. Если проводить неорганизованную нейтрализацию, можно нанести значительный вред окружающей среде.
В настоящее время имеются два варианта нейтрализующего вещества с кислотами промышленным способом. Первый предусматривает устранение фильтрующим методом сброса кислоты в стоки, с пропусканием через магнезит, известняк и другие материалы, а второй способ – регенерация кислоты специальной обработкой с последующим получением товарного продукта.
При регулярной , в том числе контроле за плотностью и уровнем электролита, можно избежать многих проблем и продлить срок эксплуатации батареи, не допустить механических разрушений. Всегда требуется внимательно относиться к устройствам при эксплуатации, особенно в зимнее время, когда при низких температурах и сниженной плотности электролита может произойти его замерзание или разрушение пластин.
В аккумуляторе какая кислота
Какая кислота в аккумуляторе автомобиля и какова ее плотность
Владельцы автомобилей часто задаются вопросом о том, какая кислота в аккумуляторе автомобиля, от которой зависит срок его службы. Производители этой продукции в основном заливают серную кислоту, представляющую кислотно-водный раствор определенной плотности и концентрации. Она называется электролитом, и для контроля его качества следует знать определенные особенности обращения, проверки и технические характеристики. В некоторых АКБ используется щелочной электролит, состоящий из элементов лития, натрия, калия и их комбинаций. В основном это сухозаряженные источники питания, которые применяются в суровых климатических условиях.
Она называется электролитом, и для контроля его качества следует знать определенные особенности обращения, проверки и технические характеристики. В некоторых АКБ используется щелочной электролит, состоящий из элементов лития, натрия, калия и их комбинаций. В основном это сухозаряженные источники питания, которые применяются в суровых климатических условиях.
Состав электролита
Электролит, или серная кислота используется современной промышленностью для производства источников тока:
- в батареях;
- аккумуляторах;
- электрических конденсаторах.
В аккумуляторы заливается серная кислота разбавленного соотношения с водой — примерно 70% воды, 30% h4SO4. При ее отсутствии устройство не пригодно к работе. Особого внимания также заслуживает плотность жидкости, которую следует проверять и при необходимости увеличивать.
Контроль плотности
Плотность в автомобильном свинцово-кислотном аккумуляторе измеряют в гр/см³, и она должна быть пропорциональна концентрации раствора с обратной зависимостью температур жидкости. Нормальный показатель — 1,27-1,29 гр/см³. Этот показатель позволяет определить состояние батареи, и если она не держит заряда, то необходимо проверить количество вещества. Со временем уровень электролита аккумулятора автомобиля сокращается, и соответственно, увеличивается плотность при гидролизе воды и нагрева. Для этого требуется периодически доливать дистиллированную воду, снижая концентрацию серной кислоты. Процедуру можно выполнить самостоятельно, если знать, сколько требуется для определенной модели вещества.
Нормальный показатель — 1,27-1,29 гр/см³. Этот показатель позволяет определить состояние батареи, и если она не держит заряда, то необходимо проверить количество вещества. Со временем уровень электролита аккумулятора автомобиля сокращается, и соответственно, увеличивается плотность при гидролизе воды и нагрева. Для этого требуется периодически доливать дистиллированную воду, снижая концентрацию серной кислоты. Процедуру можно выполнить самостоятельно, если знать, сколько требуется для определенной модели вещества.
Электролит для аккумуляторов можно приобрести в магазинах, либо сделать своими руками и научиться регулировать плотность, своевременно измерять и ухаживать за устройством для продления срока службы.
Для приготовления потребуются следующие компоненты:
- Серная кислота.
- Вода дистиллированная.
- Емкость из стекла, свинца, керамики, устойчивая к воздействию химического вещества.
- Эбонитовая баночка для размешивания.
Для приготовления в емкость заливается дистиллированная вода, затем серная кислота, и палочкой параллельно помешивается получаемая смесь.
Напомним, что при обратном проведении заливки, в частности, первой воды, возможна реакция гидратации и образования тепла в кислоте. Вероятно, что вода закипит и спровоцирует разбрызгивание.
Проверять плотность аккумулятора необходимо раз в три месяца. Для этого пользуются ареометром.
Составляющий компонент строения АКБ
Без наличия в аккумуляторе электролита не будет выполняться его основная функция, так как вещество является активатором заряда и разряда. В емкости устройства жидкости должно быть много, и, соответственно, вес аккумулятора не маленький.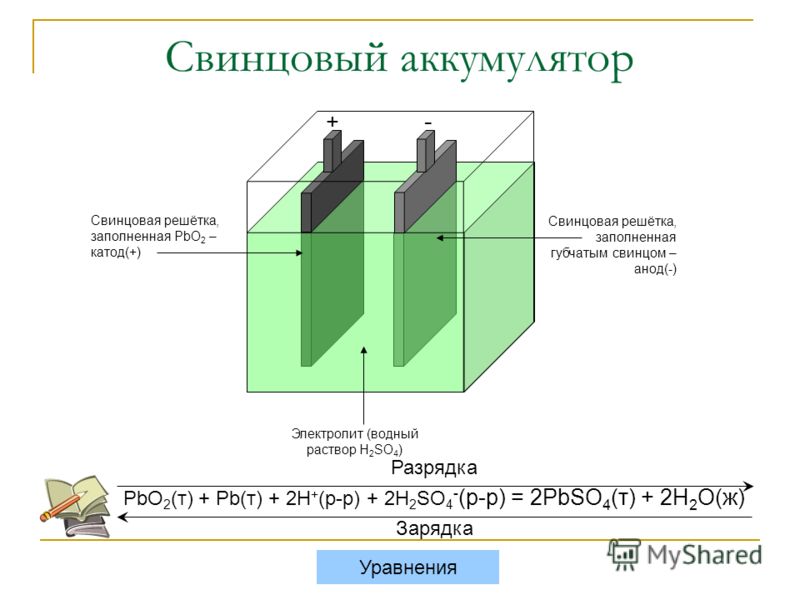 Примерное соотношение конструкции представляет до 20 % веса жидкости, до 25 % пластика и свинцовая составляющая достигает до 80 % веса. Плюсовые пластины состоят из диоксида свинца, минусовые монолитные пластины — чистый свинец. Пластины служат для сборки пакетов, способствующих накоплению заряда.
Примерное соотношение конструкции представляет до 20 % веса жидкости, до 25 % пластика и свинцовая составляющая достигает до 80 % веса. Плюсовые пластины состоят из диоксида свинца, минусовые монолитные пластины — чистый свинец. Пластины служат для сборки пакетов, способствующих накоплению заряда.
Следует отметить, что АКБ различается по моделям, и, в частности, модель 55 А/ч относится к одной из самых легких, какую можно встретить в легковых автомобилях достаточно часто. Ее вес не превышает 16 кг. Есть более компактные модели с незначительным весом, как, например, 40 А/ч и другие варианты.
Нейтрализация электролита
Если аккумулятор вышел полностью из строя, его требуется утилизировать грамотно. Но также в случае течи электролита из батареи необходимо узнать, чем нейтрализовать ее.
Бывают ситуации, когда при поломке аккумулятора может быть залита отдельная часть в месте его нахождения. Для этого необходимо вытащить батарею и провести очистку. Нейтрализация этого вещества из аккумулятора, как правило, проводится при помощи специального оборудования и применения технологий.
В настоящее время имеются два варианта нейтрализующего вещества с кислотами промышленным способом. Первый предусматривает устранение фильтрующим методом сброса кислоты в стоки, с пропусканием через магнезит, известняк и другие материалы, а второй способ – регенерация кислоты специальной обработкой с последующим получением товарного продукта. Но на практике многие водители рекомендуют в случае пролива опасного вещества использовать щелочный раствор, который делается из пищевой соды и воды.
При регулярной проверке аккумулятора, в том числе контроле за плотностью и уровнем электролита, можно избежать многих проблем и продлить срок эксплуатации батареи, не допустить механических разрушений. Всегда требуется внимательно относиться к устройствам при эксплуатации, особенно в зимнее время, когда при низких температурах и сниженной плотности электролита может произойти его замерзание или разрушение пластин.
Какая жидкость в автомобильном аккумуляторе
Практически все владельцы личного транспортного средства прекрасно знают о том, что в аккумуляторах есть кислота. Даже новички, которые только начинают постигать азы вождения, и то осведомлены касательно этого вопроса.
Многие из них слышали о кислотно-свинцовых аккумуляторах, но на деле так и не имеют представления, как именно работает это устройство. А между тем здесь протекают определенные химические реакции.
Какая кислота в аккумуляторе и для чего нужна
Большинство автомобилистов прекрасно знают, какая кислота залита в аккумуляторе. Но находятся и те, кто считают, что внутри аккумулятора ничего кроме дистиллированной воды (или дистиллята) нет. Другие же придерживаются мнения в пользу соляной кислоты, которое также неверно.
В любой автомобильной батарее содержится серная кислота — h4SO4. Если быть точнее, то речь идет о растворе серной кислоты с дистиллированной водой. Такая жидкость имеет общее название – электролит. Так какова роль серной кислоты?
Такая жидкость имеет общее название – электролит. Так какова роль серной кислоты?
Это основной компонент для работы АКБ. В отсутствие кислоты невозможен процесс заряда и разряда батареи. Это одна из самых активных разновидностей, которая способна вступать во взаимодействие практически с любым металлом, включая их оксиды. К тому же кислота может вступать в реакции обмена, а ее активность зависит от содержания воды.
Когда происходит заряд кислотного аккумулятора, пластины из чистого свинца (отрицательные) начинаются выделять электроны, которые принимаются решетками из оксида свинца (положительные). При разряде батареи происходит в точности до наоборот. Иными словами, когда пластины отдают электроны, они как бы «разрушаются» – происходит заряд, а при разряде они возвращаются обратно, что именуется «восстановлением».
И вот как раз для такого процесса разрушения – восстановления и нужна агрессивная среда в виде разбавленной серной кислоты. И без нее эффективность автомобильных батарей была бы на очень низком уровне.
Состав электролита и как правильно сделать
- сама кислота – 30%;
- дистиллированная вода – 70%.
Именно такая субстанция эффективным образом взаимодействует со свинцовыми пластинами. При этом особого внимания заслуживает плотность электролита, на что непосредственным образом оказывает влияние серная кислота. У концентрированной она достигает показателя в 1,83 г/см3. Добавлением дистиллированной воды обеспечивается понижение плотности до нужных пределов – обычно это диапазон 1,23-1,27 г/см3.
| 1,27 | 12,66 | 10,8 | 100 | -60 |
| 1,26 | 12,6 | 10,66 | 94 | -55 |
| 1,25 | 12,54 | 10,5 | 87,5 | -50 |
| 1,24 | 12,48 | 10,34 | 81 | -46 |
| 1,23 | 12,42 | 10,2 | 75 | -42 |
| 1,22 | 12,36 | 10,06 | 69 | -37 |
| 12,3 | 9,9 | 62,5 | -32 | |
| 1,2 | 12,24 | 9,74 | 56 | -27 |
| 1,19 | 12,18 | 9,6 | 50 | -24 |
| 1,18 | 12,12 | 9,46 | 44 | -18 |
| 1,17 | 12,06 | 9,3 | 37,5 | -16 |
| 1,16 | 12 | 9,14 | 31 | -14 |
| 1,15 | 11,94 | 9 | 25 | -13 |
| 1,14 | 11,88 | 8,84 | 19 | -11 |
| 1,13 | 11,82 | 8,68 | 12,56 | -9 |
| 1,12 | 11,76 | 8,54 | 6 | -8 |
| 1,11 | 11,7 | 8,4 | 0,0 | -7 |
Знать этот параметр необходимо для понимания порога замерзания электролита. При плотности в 1,11 г/см3 субстанция замерзает уже под воздействием относительно небольшого холод: -7 °C. У рекомендованных значений порог этот существенно отличен – от -58 °C до -64 °C. А можно ли самому сделать электролит?
Да, это действительно возможно, только действовать необходимо с предельной осторожностью. И поскольку предстоит иметь дело с серной кислотой высокой концентрации, то такая работа представляет определенную опасность. Необходимо позаботиться о защите рук, тела, органов дыхания.
Собственно в том, чтобы самостоятельно приготовить электролит для АКБ, нет ничего сложного – смешать серную кислоту с дистиллированной водой, соблюдая пропорцию. Стоит заметить, что обычна вода из-под крана для таких целей не подходит, поскольку содержит большое количество разных примесей, которые негативным образом воздействуют на свинцовые пластины.
Собственно сами ингредиенты:
- Серная кислота (плотность должна быть 1,83 г/см3 или более, но не менее).
- Дистиллированная вода.
- Любая фарфоровая посуда.
Пропорции кислоты и воды нам известны – 30% и 70% соответственно. При этом важен характер подхода к производству – оптимально кислоту добавлять в воду, а не наоборот. Также стоит учесть, что при их смешивании будет выделяться очень много тепловой энергии и по этой причине недопустимо использовать стеклянную посуду – она просто лопается. Когда температура электролита упадет, его можно перелить в стеклянную емкость или тару из пластика.
После того как жидкости будут соединены, следует замерить плотность ареометром. Если показатели соответствуют допустимому пределу, электролит готов к эксплуатации. Но такое приспособление имеется далеко не у каждого водителя, а поэтому пригодится следующая подсказка плотности электролита (из расчета на 1 литр дистиллированной воды):
- при 1,23г/см3 – 280г;
- при 1,25г/см3 – 310г;
- при 1,27г/см3 – 345 г;
- при 1,29г/см3 – 385 г.
Собственно на этом работа и заканчивается. Тем, кто проживает в средней полосе России, следует придерживаться плотности – 1,27 г/см3. При этом для зон с холодным климатом (до -30 °С) допустимый показатель составляет 1,26-1,28 г/см3, а жарких субтропических районов – 1,24-1,26 г/см3. Пределы плотности от 1,27 г/см3 до 1,29 г/см3 актуальны для тех регионов, где зима свирепствует до -50 °С.
К чему приведет нарушение рецептуры
Показатель в 1,29 г/см3 является не самым высоким – встречается концентрат электролита с плотностью 1,33 г/см3 (применяется для корректировки), ранее можно было найти даже с плотность 1,4 г/см3, но сейчас он снят с продажи. Однако его все же следует также разбавить водой и только после этого заливать внутрь АКБ. Почему же нельзя лить сильно концентрированный электролит?
Ничего хорошо уж точно не произойдет! Из-за высокой концентрации страдают пластины аккумулятора – их просто разъедает со временем. Это происходит медленно, но верно! Поэтому, если залить высокий концентрат, не следует удивляться тому, что АКБ в скором времени вышла из строя.
Низкая плотность электролита приводит к такому явлению, которое называется сульфатацией. Об этом процессе известно многим опытным водителям. В результате на пластинах оседают кристаллы сульфита свинца, из-за чего металл утрачивает способность к накоплению заряда.
Читайте также: Почему греется телефон и быстро садится батареяК тому же, как выше уже было упомянуто, из-за слишком низких показателей плотности электролит замерзает, обращаясь в лед. Чем это грозит, каждому уже понятно – повреждения пластин не избежать.
Как корректировать плотность жидкости
Владельцам автомобилей необходимо контролировать уровень электролита и его плотность. Из-за гидролиза и нагрева АКБ в подкапотном пространстве содержание субстанции понижается, а плотность наоборот растет. По этой причине возникает необходимость доливать дистиллированную воду. Но иногда показатели плотности электролита могут стать меньше нормы. Тогда следует поднять концентрацию кислоты.
Существуют несколько способов как это можно сделать, исходя из степени понижения плотности электролита. Для этого следует замерить его концентрацию в каждой банке по отдельности. Если густота электролита получена от 1,18 г/см3 до 1,20 г/см3, то оптимальное решение – замена части электролита в банке на новый с плотностью 1,27 г/см3. Иными словами делается повышение плотности электролита.
Только предварительно стоит убедиться в том, что АКБ заряжена, иначе батарею следует подзарядить. При низком заряде аккумулятора к такой процедуре нельзя приступать. Иначе концентрация h4SO4 резко поднимется, что приведет только к разрушению пластин.
Сама же процедура выполняется в следующем порядке:
- Резиновой грушей откачивает как можно больше жидкости из банки. При этом замерить объем.
- Добавляют новый корректирующую жидкость с плотностью 1,27-1,29 гр/см3 в количестве равном половине изъятого объема.
- Пусть все перемешается между собой – для этого можно дать нагрузку на выводы, просто подождать некоторое время или потрясти АКБ.
- Замеряют плотность. Если показатели по-прежнему не достигли допустимых пределов доливку электролита стоит продолжать до достижения нужных параметров.
- Когда предел установлен, банки закрывают, а сам аккумулятор ставится на зарядку.
В том случае, когда плотность электролита снижена ниже уровня в 1,2 гр/см3, тогда необходимо менять его полностью – сливать старый, заливать новый.
Подробно о том, какая кислота залита в аккумуляторе вашего автомобиля и для чего она нужна
Многие автолюбители задают себе вопрос о том, какая кислота залита в аккумуляторе автомобиля. По незнанию высказываются различные неверные предположения. Кто-то говорит, что там соляная кислота. Некоторые считают, что там вода. Пора внести ясность в этот вопрос. В свинцово-кислотном аккумуляторе автомобиля залита серная кислота. Если выражаться совсем точно, то залит раствор серной кислоты в дистиллированной воде. Этот раствор получил название электролит.
Применение серной кислоты и её сорта
Вообще, в качестве электролита в некоторых видах автомобильных аккумуляторов может использоваться щёлочь. Например, никель-кадмиевый или никель-железный тип АКБ. Есть ещё группа гелевых аккумуляторов AGM и GEL, где электролит находится в связанном состоянии. Но это тот же раствор серной кислоты. Просто он либо переведён в гелеобразное состояние с помощью добавок (GEL), либо им пропитано стекловолокно (AGM). Наиболее распространёнными на сегодняшний день остаются свинцово-кислотные автомобильные аккумуляторы с жидким электролитом. Поэтому речь пойдёт именно о водном растворе серной кислоты, предназначенном для заливки в АКБ.
Электролит
Дистиллированная вода
Серная кислота используется в самых разных отраслях народного хозяйства. К примеру, с её помощью очищается поверхность металла перед нанесением покрытия, она используется при приготовлении различных синтетических красителей. Кроме того, серная кислота востребована в сфере производства удобрений, взрывчатки, фармакологической промышленности, переработке нефти.Серная кислота нашла широкое применение при производстве свинцово-кислотных аккумуляторов для автомобилей. Концентрация кислоты в электролите составляет 30-35 процентов (вес.). Остальное дистиллированная вода. Использовать обычную водопроводную воду нельзя, поскольку в ней содержатся соли различных металлов. Их попадание в аккумулятор автомобиля значительно сократит срок его службы.
В бытовой сфере концентрации Н2SO4 в 30 процентов достаточно, но в сфере производства часто используется серная кислота более высокой концентрации. Концентрированную серную кислоту получают в две стадии. На первой стадии концентрация доводится до 70 процентов, а затем увеличивают до 98 процентов. Серная кислота такой концентрации наиболее пригодна для последующего хранения. Возможно, получение концентрации 99 процентов, но в дальнейшем из-за потери SO3 она снижается до 98,3 процента.
Существуют основные сорта серной кислоты, которые перечислены ниже:
- Башенная или нитрозная. Концентрация 75 процентов. Плотность этого сорта составляет 1,67 гр/см3. Название этот сорт получил из-за метода производства в футерованных башнях нитрозным способом. Обжиговый газ с двуокисью серы (SO2) обрабатывается нитрозой (h4SO4 с добавками оксидов азота). В ходе химической реакции получается оксиды азота и кислота. При этом оксиды постоянно циркулируют в производственном цикле;
- Контактная. Концентрация от 92,5 до 98 процентов. Плотность сорта составляет 1,837 гр/см3. Этот сорт также производится из обжигового газа, в котором содержится двуокись SO2. В ходе реакции происходит ее окисление до SO3 при контакте с твёрдым катализатором из ванадия;
- Сорт Олеум. Концентрация 104,5 процента. Плотность составляет 1,897 гр/см3. Сорт представляет собой раствор SO3 в серной кислоте (h4SO4). Соотношение SO3 — 20 процентов, h4SO4 — 104,5 процента;
- Высокопроцентный олеум. Концентрация 114,6 процента, а плотность 2,002 гр/см3;
- Аккумуляторная. Концентрация от 92 до 94 процента, а плотность 1,835 гр/см3.
Вернуться к содержанию
Процессы, происходящие в АКБ с участием электролита
Работа свинцово-кислотного автомобильного аккумулятора основывается на электрохимических процессах, которые протекают с участие электролита. Аккумулятор автомобиля состоит из положительных и отрицательных пластин, погруженных в водный раствор серной кислоты. Положительные и отрицательные пластины имеют токоотводящие решётки из свинца с различными добавками в зависимости от типа аккумулятора.
На решётках положительных электродов нанесён красновато-коричневый диоксид свинца (PbO2). На отрицательных электродах — сероватый порошок свинца (Pb). Электрические характеристики аккумулятора напрямую зависят от плотности электролита. Для понимания назначения электролита нужно рассмотреть основные процессы, происходящие в аккумуляторе автомобиля.
При разряде аккумулятор на положительном электроде (аноде) идёт следующая реакция:
PbO2 + SO42− + 4H+ + 2e− -> PbSO4 + 2h4O
На отрицательном электроде (катоде) протекает такой процесс:
Pb + SO42− − 2e− ->PbSO4
При заряде АКБ эти реакции протекают в обратном направлении.
Электролит в свинцово-кислотном автомобильном аккумуляторе имеет разную плотность в зависимости от степени заряженности АКБ. Как уже говорилось выше, концентрированная кислота аккумуляторного сорта имеет плотность 1,835 гр/см3. Плотность электролита на заряженном аккумуляторе лежит в диапазоне 1,127─1,300 гр/см3. При разрядке аккумулятора автомобиля в результате электрохимической реакции из электролита расходуется серная кислота и его плотность падает. Пока через батарею проходит ток разряда кислота рядом с электродами расходуется в результате вышеописанной реакции. Идёт диффузия h4SO4 из объёма к электродам. Таким образом, поддерживается напряжение на выводах аккумулятора.
В начале разрядки процесс диффузии кислоты в электроды. Это объясняется тем, что в активной массе электродов поры ещё не забиты сульфатом. По мере того, как на них образуется слой сульфата и забивает поры, процесс диффузии притормаживается. В теории процесс разряда может идти до того момента, пока электролит не превратится в воду. Но на практике разряд идёт до тех пор, пока плотность не опуститься до значения 1,15 гр/см3. К моменту падения плотности до 1,15 гр/см3 выделяется столько сульфата свинца, что его хватило для закупоривания активной массы пластин. По плотности электролита можно судить о степени заряженности АКБ. Для этого можно использовать таблицу, представленную ниже.
| 1,11 | 11,7 | 8,4 | 0 | -7 |
| 1,12 | 11,76 | 8,54 | 6 | -8 |
| 1,13 | 11,82 | 8,68 | 12,56 | -9 |
| 1,14 | 11,88 | 8,84 | 19 | -11 |
| 1,15 | 11,94 | 9 | 25 | -13 |
| 1,16 | 12 | 9,14 | 31 | -14 |
| 1,17 | 12,06 | 9,3 | 37,5 | -16 |
| 1,18 | 12,12 | 9,46 | 44 | -18 |
| 1,19 | 12,18 | 9,6 | 50 | -24 |
| 1,2 | 12,24 | 9,74 | 56 | -27 |
| 1,21 | 12,3 | 9,9 | 62,5 | -32 |
| 1,22 | 12,36 | 10,06 | 69 | -37 |
| 1,23 | 12,42 | 10,2 | 75 | -42 |
| 1,24 | 12,48 | 10,34 | 81 | -46 |
| 1,25 | 12,54 | 10,5 | 87,5 | -50 |
| 1,26 | 12,6 | 10,66 | 94 | -55 |
| 1,27 | 12,66 | 10,8 | 100 | -60 |
Полностью заряженный элемент АКБ автомобиля выдаёт напряжение 2,5─2,7 вольт без нагрузки на выводах. При подключении нагрузки напряжение проседает до 2,1 вольта за несколько минут. За это время успевает сформироваться слой PbSO4 на поверхности отрицательных электродов. То есть, напряжение одного элемента на подключённой к автомобилю АКБ составляет примерно 2,15 вольта.
Если разряжать аккумулятор автомобиля небольшим током (10 процентов от номинальной ёмкости), то через час разрядки напряжение элемента снижается до 2 вольт. Это происходит из-за того, что в этом момент быстро формируется большое количество PbSO4, который забивает поры активной массы. В результате растёт внутреннее сопротивление элементов АКБ и падает концентрация электролита. Через некоторое время процесс разрядки выходит на прямую (см. график).
График разрядки аккумулятора
Эта прямая соответствует балансу плотностью электролита около электродов и в остальном объёме. Постепенно кислота поступает из объёма к электродам и вступает в реакцию с выделением сульфата свинца. Плотность электролита постепенно снижается, а напряжение падает медленнее, чем на начальной стадии. И на конечной стадии, когда активная масса блокируется образовавшимся сульфатом свинца, реакция замедляется и напряжение быстро падает. Вернуться к содержанию
Контроль за состоянием электролита в АКБ?
От владельца автомобиля требуется периодически контролировать уровень электролита в аккумуляторе и его плотность. Для контроля уровня электролита можно использовать стеклянную трубочку. Если её под рукой нет, то можно использовать прозрачный пластиковый корпус от старой шариковой ручки. Для измерения уровня электролита отворачиваете пробки банок батареи и погружаете трубочку до пластин. Затем с верхнего конца плотно зажимаете пальцем и поднимаете. Уровень электролита в трубочке должен составлять 10─12 миллиметров.
В случае нехватки электролита долейте дистиллированной воды до необходимого уровня. Лучше покупайте дистиллированную воду в аптеке. В автомобильных магазинах под видом дистиллированной воды часто продают обычную водопроводную. Выше требуемого уровня воды также заливать не следует. В необслуживаемых автомобильных аккумуляторах (ссылка на материал) доливка дистиллированной воды не требуется. У них сниженный расход воды и они, как правило, имеют крышку с системой рециркуляции электролита.
Внимание! Не допускайте эксплуатации аккумуляторной батареи с уровнем электролита ниже верхней части пластин. Это значительно сокращает срок его службы.
Для того, чтобы измерить плотность Вам потребуется ареометр. Это приспособление представляет собой запаянную стеклянную трубку, в которой находиться ртуть или дробь. На верхнем конце ареометра имеется градуированная шкала. Диапазон измерений плотности 1,100─1,300 гр/см3. Ареометр помещён в разборную колбу с грушей.
Ареометр
Вам нужно опустить нижнюю часть в банку и набрать электролита. После этого вынимаете и смотрите, на каком значении находится уровень электролита. Сам ареометр будет плавать в электролите наподобие поплавка. На некоторых моделях ареометров шкала со значениями может быть заменена надписями «Полный заряд», «Половина», «Разряжен».
Вернуться к содержанию
Как поднять плотность электролита?
Выше уже говорилось о том, что в результате гидролиза воды и нагрева АКБ под капотом уровень электролита постепенно уменьшается и растёт его плотность. Поэтому периодически нужно доливать дистиллированной воды. А что, если плотность электролита на заряженном аккумуляторе автомобиля, наоборот, меньше нормы (1,275 гр/см3)? Тогда нужно поднять концентрацию кислоты.
Внимание! Во время работ с кислотой одевайте резиновые перчатки и защитные очки. Если вы будете самостоятельно разводить электролит из концентрированной кислоты и дистиллированной воды, помните, что нельзя наливать воду в кислоту. В этом случае начинается реакция гидратации с выделением большого количества тепла. В результате вода закипает и провоцирует брызги кислоты, что очень опасно. Поэтому при разбавлении нужно лить кислоту в воду.
При поднятии плотности электролита может быть два варианта. Если средняя плотность по всем банкам не ниже 1,2 гр/см3, то нужно поднять плотность постепенным разбавлением.
Для каждой из банок нужно проделать следующие действия:
- Откачиваете как можно больше электролита из банки. Для этого можно использовать резиновую грушу или ту же колбу. После этого в банку заливаете электролит (плотность 1,275─1,29 гр/см3) половину откачанного объёма;
- Для того чтобы электролит перемешался, можно дать на выводы нагрузку (например, подключить автомобильную лампочку) или просто подождать некоторое время;
- Затем делаете замер плотности. Если она не поднялась до нужного уровня, то заливаете электролит в половину от оставшегося объема;
- Перемешивание и снова замер;
- Доводите плотность кислоты до требуемого уровня.
Если плотность электролита ниже 1,2 гр/см3, то здесь уже нужно его менять полностью. То есть, сливать старый и заливать новый, требуемой плотности. Но, если электролит имеет такую низкую плотность в заряженном состоянии, то возникают сомнения в целесообразности его дальнейшего использования. В этом случае электролит имеет смысл менять только если АКБ относительно новая (до года). Иногда встречаются аккумуляторы автомобиля с такой плотностью электролита прямо из магазина. Если это уже отработавшая несколько лет батарея, то лучше купить новую. При утилизации аккумуляторов отработавший электролит также идет на переработку. Вернуться к содержанию
Из этой статьи читатели должны были узнать о том, какая кислота залита в аккумулятор автомобиля, какую плотность она должна иметь. Отдельно были рассмотрены химические реакции, проходящие в автомобильном аккумуляторе с участием электролита. Также были даны рекомендации по поддержанию уровня и плотности электролита и приспособлениях, которые для этого требуются. Если у вас остались вопросы или есть пожелания, пишите их в комментариях. Вернуться к содержанию
Какая кислота в аккумуляторе автомобиля
Знать, какая кислота в аккумуляторе автомобиля, обязан каждый водитель, самостоятельно обслуживающий своё транспортное средство. Этот вопрос вызван не праздным любопытством, имеющим цель расширить кругозор. Применяя знания такого рода на практике, можно не только продлить срок службы аккумуляторной батареи, но и избежать возникновения неприятных, а подчас и опасных ситуаций, в которые рискует попасть неподготовленный человек.
Для чего нужна кислота
Прежде чем приступать к описанию процессов, протекающих при разряде/заряде, стоит сразу сказать, какая кислота используется в аккумуляторе любого автомобиля – это серная (h4SO4), а не соляная или, например, фосфорная.
Она необходима для приготовления электролита – жидкости, в которой присутствуют заряженные частицы – ионы. Электролит представляет собой не просто пассивный раствор, в котором частицы воды и кислоты перемешаны друг с другом. Это активная жидкость, отличительная особенность которой – постоянное протекание в ней взаимно исключающих друг друга процессов – диссоциации и ассоциации.
В аккумуляторе присутствует серная кислотаПри диссоциации, которая протекает лишь в водном растворе h4SO4. Молекулы кислоты образуют ионы с положительными и отрицательными зарядами:
Диссоциация кислотыПараллельно с диссоциацией протекает обратный процесс – превращение ионов в молекулы кислоты. Полной ионизации электролита, а также полной нейтрализации заряженных частиц не происходит. Процессы находятся в динамическом равновесии, которое может измениться лишь под влиянием внешнего воздействия.
Именно наличие ионов и превращает раствор в электролит. Под влиянием электрического поля (во время зарядки) заряженные частицы переносят заряд к пластинам аккумулятора. При реакции между ионами и веществом пластин происходит высвобождение электронов. Они способны двигаться по проводнику при подключении его к электродам (их выводам).
Основные процессы, протекающие при разряде
Отрицательные пластины АКБ и их обмазка изготовлены из свинца (Pb), а у положительных активная масса имеет основой его диоксид (PbO2). Металлический свинец обладает большим количеством свободных электронов, чем его диоксид. Если положительную и отрицательную пластины соединить проводником, то разность потенциалов практически сразу уравновесится и электрический ток не возникнет.
Но если эти пластины погрузить в сернокислотный электролит, то перенос электронов вызовет химические реакции окисления металлического свинца и восстановления его диоксида:
PbO2 + SO42- + 4H++ 2e- = PbSO4 + h4O
Как видите, «конечными продуктами» этих реакций являются:
- Сульфат свинца PbSO4, образующийся на поверхности пластин.
- Вода.
- Свободные электроны (e-), благодаря которым и возникает электрический ток.
При достаточно продолжительном разряде серная кислота может полностью «израсходоваться» на образование сульфата и воды, в результате чего прекратятся химические реакции и свободные электроны не будут образовываться. Поэтому особенно ценным в плане практического использования свинцовых аккумуляторных батарей является возможность протекания обратных реакций при подключении к выводам электрического напряжения.
При зарядке сульфат свинца, прореагировав с водородом, снова становится серной кислотой, в результате чего плотность электролита восстанавливается, а поверхность пластин аккумулятора приобретает первоначальный состав.
Проверка плотности электролитаСостав электролита
Химический состав раствора прост – 35% серной кислоты + 65% воды. Такое соотношение обусловлено как необходимостью сохранить работоспособность батареи при низких температурах (до -65 С). А также избежать чрезмерной коррозии пластин – серная кислота очень агрессивна.
Разумеется, вода должна быть дистиллированной, а кислота соответствовать по чистоте ГОСТ 667-73, устанавливающему минимальные нормы содержания примесей.
При обслуживании аккумуляторов состав аккумуляторной кислоты оценивается по плотности, измеряемой ареометром. При температуре воздуха +20 С её значение должно быть 1,28 г/см3.
Но для автомобилистов необходимость самостоятельно изготавливать электролит для батареи практически отпадает. В автомагазинах продаётся как готовый раствор (плотностью 1,28 г/см3), так и корректирующий (1,4 г/см3). Также можно купить и дистиллированную воду – при необходимости её доливки.
Контроль за состоянием электролита
В первую очередь, на что должен обращать внимание владелец при уходе за батареей – это уровень электролита. Пластины должны быть полностью погружены в раствор. Расстояние от поверхности жидкости до верхнего края пластин – около 10-15 мм.
Знать, сколько жидкости должно быть в аккумуляторе, нужно лишь в тех случаях, когда вы собираетесь её поменять целиком. Объём электролита зависит от ёмкости АКБ, примерные его значения приведены в таблице:
Но замена электролита потребует слива отработанного раствора. Для чего потребуется сверлить корпус батареи и затем восстанавливать его целостность. Опрокидыванием выливать ни в коем случае нельзя. Шлаком, скопившемся на дне, можно спровоцировать замыкание пластин и окончательный выход АКБ из строя.
Поэтому уход за батареей, который имеет практическую значимость, сводится к возобновлению уровня электролита и контролю его плотности.
Что представляет собой электролит и насколько он опасен
Электролит в автомобильных аккумуляторах, представленных в продаже, — та среда, в которой происходят химические реакции, в результате которой происходит накопление и отдача электроэнергии для питания электрооборудования транспортного средства при выключенном двигателе.
Электролит, присутствующий в автомобильных и мотоаккумуляторах, представлен разбавленной серной кислотой. Это – агрессивная химическая среда, требующая осторожного обращения. Попадание брызг электролита на кожу или в глаза вызывает очень болезненные ощущения и ожоги. Вылечить их трудно.
Свинцово-кислотный АКБ — один из самых распространенных типов аккумуляторных батарей, использующийся как источник электроэнергии в автомобилях, мотоциклах, мопедах и прочих ТС. Необходимость купить автомобильные аккумуляторы этого типа возникает у большинства авто-мото-любителей. Вот почему с электролитом приходится иметь дело многим владельцам транспортных средств.
Меры предосторожности при обращении с электролитом:
- Серная кислота (h3SO4) – ядовитое вещество, поэтому, работая с АКБ, обязательно надевайте специальные очки, резиновые перчатки и фартук. Они защитят от ожогов, порчи кузова машины, мотоцикла и т.д., одежды.
- На этот случай всегда имейте под рукой нейтрализующие аккумуляторную кислоту средства – раствор нашатырного спирта или соду. При попадании электролита на тело и проч. сразу же нейтрализуйте ее действие, потом смойте струей воды. При попадании в глаза промывайте их не менее четверти часа, после чего сразу же обращайтесь к врачу.
- Если Вы предпочитаете не покупку готового электролита для АКБ своего автомобиля или мототехники, а готовите самостоятельно, то советуем вливать концентрированную h3SO4 в воду тонкой струей (только в не металлическую емкость), постоянно помешивая раствор. Поступать наоборот — вливать воду в кислоту — недопустимо. В этом случае в результате выделяемого при смешивании тепла образуются капельки кислоты, которые начинают брызгать в разные стороны.
- При постановке свинцово-кислотных автоаккумуляторов на зарядку, не закручивайте пробки заливочных емкостей. Дайте образующимся в процессе зарядки батареи газам свободный выход иначе корпус АКБ взорвется.
- При постановке кислотных обслуживаемых аккумуляторов обязательно выкручиваются пробки заливочных отверстий для свободного выхода образующихся в процессе зарядки газов. В противном случае скопившийся в корпусе водород взорвет аккумулятор.
Выбирая автомобильный аккумулятор в Балашихе или Реутове, можно остановиться на современной необслуживаемой модели. Если же Вы предпочитаете обслуживаемую АКБ, то при работе с ней не пренебрегайте общими мерами предосторожности.
Поблизости от заряжающейся батареи нельзя допускать открытого огня, искр (проводить сварные работы, например), короткого замыкания, курить. Помещение, где происходит зарядка, должно хорошо проветриваться. Если есть необходимость в проверке токопроводящих кабелей автомобиля, то обесточьте электрическую систему и не включайте зажигание. Присоединяя и отсоединяя провода зарядного устройства к АКБ, тоже сначала обесточьте его. И последняя предосторожность, которую нужно строго соблюдать автолюбителю: первым при отключении автоаккумулятора отсоединяйте провод массы, а при подключении он подсоединяется последним.
Предупреждения | Главная
Аккумуляторы, полюса, терминалы и соответствующие части содержат свинец, свинцовые сплавы и другие химические вещества. В целях предотвращения серьезного нанесения вреда здоровью, после любой работы с аккумулятором следует тщательно промыть руки с водой и мылом.
Работая с аккумулятором и в среде, где находится аккумулятор, следует всегда использовать защитные очки, маску и перчатки.
Газообразующий водород, вырабатываемый аккумулятором, является очень воспламеняемым. Поэтому, помещения для зарядки аккумуляторов должны хорошо проветриваться.
Аккумуляторы следует держать подальше от источников искры, горящих сигарет, сварки, трения, статического электричества и других предметов и воздействий, которые могут вызвать воспламенение. В противном случае, газ может загореться и взорваться. Кроме того, в целях предотвращения возможного появления искры, сначала надо отсоединить заземленный кабель и затем в самом конце подсоединить его.
При демонтаже аккумулятора из автомашины, сначала необходимо отсоединить отрицательный (-) полюс, а при установке аккумулятора, сначала необходимо соединить положительный (+) полюс.
Во время зарядки производите прямое соединение и отсоединение. Для предотвращения искрообразования, при соединении или отсоединении концов кабелей, сначала необходимо отключить приборы зарядки и тестирования.
Жидкозаряженные аккумуляторы не следует наклонять в какую-либо сторону больше 45 градусов. Аккумуляторы содержат серную кислоту, которая может стать причиной серьезных ожогов. При попадании кислоты на кожу, необходимо обильно смыть ее водой с мылом. В случае попадания в глаза, сразу после промывки водой необходимо обратиться к врачу.
- Во время зарядки, тестирования или соединения одного аккумулятора к другому, не наклоняйтесь над аккумулятором.
- Перед началом зарядки замерзшего аккумулятора, подождите, пока его температура не достигнет 15 градусов.
- Не устанавливайте аккумулятор в машину, не убедившись, что вольтаж находится в правильном направлении.
- Храните аккумулятор и электролит в недоступных для детей местах.
Положения, на которые следует обратить внимание для правильного использования аккумулятора:
- Поверхность аккумулятора должна быть чистой и сухой.
- Соединения аккумулятора должны быть прочными и не должны окисляться.
- В соответствующих типах аккумулятора, то необходимо проверить уровень электролита. Если уровень низкий, то добавьте дистиллированную воду. Категорически запрещается добавлять кислоту.
- В случае необходимости хранения аккумулятора на протяжении длительного времени, аккумулятор должен быть полностью заряжен.
- Обязательно соблюдайте инструкцию.
Серная кислота аккумуляторная
Описание:Серная кислота — бесцветная маслянистая жидкость, не имеющая запаха. С водой и серным ангидридом смешивается в любых соотношениях с выделением большого количества тепла. Контактная серная кислота с массовой долей моногидрата 92,5-94,0% является водным раствором моногидрата (100% серной кислоты). В технике под серной кислотой подразумевают любые соединения H2SO4 с водой. Водные растворы серной кислоты характеризуются массовой долей в них H2SO4 или SO3
Серная кислота — одна из самых активных неорганических кислот. Она реагирует почти со всеми металлами и их оксидами, вступает в реакции обмена, обладает окислительными и другими важными свойствами. Основные физико-химические свойства растворов серной кислоты зависят от соотношения в ней воды и серного ангидрида (триоксида серы).
Применение:Серная кислота используется в производстве минеральных удобрений, красителей, химических волокон, а также в металлургии. Она применяется для различных технологических целей в текстильной, пищевой и др. отраслях промышленности. Аккумуляторная серная кислота применяется после разбавления ее дистиллированной водой в качестве электролита для заливки свинцовых аккумуляторов.
В качестве электролита для аккумуляторных батарей применяют раствор серной аккумуляторной кислоты в дистиллированной воде. Для различных климатических и температурных условий, в которых батарее предстоит работать, используют электролит различной плотности. Плотность электролита зависит от концентрации раствора серной аккумуляторной кислоты — чем больше концентрация раствора, тем больше плотность электролита и от температуры раствора — чем выше температура, тем ниже плотность. Концентрация или плотность электролита является точным критерием степени разряженности аккумулятора. В качестве точки отсчета, для определения текущей степени разряженности аккумулятора, принимается нормативная плотность электролита, т.е. плотность, приобретенная после первого полого заряда. Для свинцовых аккумуляторов характерно сильное разбавление электролита во время разряда из-за участия в реакции серной аккумуляторной кислоты с образованием воды. В заряженных аккумуляторах концентрация кислоты равна 30…40%. Чем меньше объем электролита, в сравнении с массой электродов, тем быстрее снижается концентрация кислоты при разряде. В конце разряда она составляет от 10 до 25%.
Серная кислота
ГОСТ 667-73
Влияние суперпластификатора и ускорителя набора прочности ПФМ-НЛК на подвижность бетонной смеси и прочностные характеристики бетона
| Технические характеристики | Высший сорт | Первый сорт |
|---|---|---|
| Массовая доля моногидрата (H2SO4), % | 92-94 | 92-94 |
| Массовая доля железа (Fe), % | 0,005 | 0,01 |
| Массовая доля остатка после прокаливания, %, не более | 0,02 | 0,03 |
| Массовая доля оксидов азота (N2O4), %, не более | 0,00003 | 0,00001 |
| Массовая доля мышьяка (As), %, не более | 0,00005 | 0,00008 |
| Массовая доля хлористых соединений (Cl), %, не более | 0,0002 | 0,0003 |
| Массовая доля марганца (Mn), %, не более | 0,00005 | 0,0001 |
| Массовая доля суммы тяжелых металлов в пересчете на свинец (Pb), %, не более | 0,01 | 0,01 |
| Массовая доля меди (Cu), %, не более | 0,0005 | 0,0005 |
| Массовая доля веществ, восстанавливающих KMnO4, см3 раствора с (1/5 KMnO4) = 0,01 моль/дм3, не более | 4,5 | 7 |
| Прозрачность | Должна выдерживать испытание по п. 3.13 | |
Серная кислота упаковывается в ж/д и авто цистерны, канистры, кубовые емкости.
Хранение:Техническая серная кислота и олеум (концентрированная серная кислота) должны храниться в емкостях из стали или спецстали, как нефутерованных, так и футерованных кислотоупорным кирпичом или кислотоустойчивым материалом.
Транспортировка:
Серную кислоту техническую транспортируют в железнодорожных сернокислотных цистернах в соответствии с правилами перевозок грузов. На цистерны должны быть нанесены специальные трафареты в соответствии с правилами перевозок грузов, действующими на ж.д. транспорте.
Кислота серная пожаро- и взрывобезопасна, при соприкосновении ее с водой происходит бурная реакция с большим выделением тепла, паров и газов. Токсична. По степени воздействия на организм относится к веществам 2-го класса опасности. При работе с серной кислотой обязательно применять спецодежду.
Технология залитого аккумулятора от VARTA®
VARTA® предлагает обширную линейку залитых свинцово-кислотных аккумуляторов для широкого диапазона автомобилей. Каждый аккумулятор создан, чтобы отвечать специфическим требованиям наших потребителей во всем мире — как производителей оборудования, так и покупателей на рынке компонентов.
Залитые свинцово-кислотные аккумуляторы являются наиболее распространенным типом аккумуляторов. Жидкий электролит, состоящий из серной кислоты и воды, покрывает все внутренние детали. Залитые аккумуляторы VARTA обладают герметичной конструкцией, поэтому они защищены от протеканий.
Залитые аккумуляторы для легковых автомобилей
Наши залитые 12-вольтовые аккумуляторы разработаны, чтобы удовлетворять потребности в электроэнергии современных автомобилей, и обеспечивают надежную пусковую мощность снова и снова в самых сложных климатических условиях. В них используется наша эксклюзивная технология решетки PowerFrame®.
Залитые аккумуляторы для водного транспорта
Мы предлагаем широкий диапазон пусковых аккумуляторов и аккумуляторов глубокого цикла для водного транспорта, которые позволяют нашим покупателям дольше быть на воде. Мы предлагаем аккумуляторы для водного транспорта на любой вкус: от высокомощных стартерных аккумуляторов до стандартных или улучшенных аккумуляторов глубокого разряда с жидким электролитом. В отличие от стандартных залитых аккумуляторов, аккумуляторы VARTA Professional Dual Purpose защищены от разлива и позволяют наклонять себя до 90° на короткое время.
Преимущества:
- Стартерные аккумуляторы обеспечивают короткий и мощный импульс для запуска двигателя.
- Аккумуляторы глубокого разряда запускают двигатели и питают приборы, если двигатели не запущены.
- Более прочная конструкция с улучшенными характеристиками работы в циклическом режиме продлевают время эксплуатации для применений с глубоким разрядом.
Залитые аккумуляторы для гольф-мобилей
Нужен ли вам аккумулятор для перемещения по полю для гольфа или надежный источник энергии для промышленного применения, типа ножничных подъемников или поломоечных машин, наши аккумуляторы для гольф-мобилей обеспечивают необходимую производительность в режиме глубокого разряда.
Преимущества:
- Активная масса высокой плотности и сплав решетки со специальной формулой позволяют аккумулятору выдерживать нагрузку множественных циклов разряда.
- Механически соединенные отверстия для удобного долива воды.
- Прочные пластины и плотная установка компонентов для виброустойчивости.
Залитые аккумуляторы для газонокосилок и садовой техники
Наши аккумуляторы для газонокосилок и садовой техники разработаны так, чтобы обеспечивать надежную пусковую мощность раз за разом. Характеристики продукта:
- Удобная конструкция, не требующая обслуживания.
- Конверты-сепараторы защищают пластины, обеспечивают необычайную пусковую мощность и предотвращают от внутреннего замыкания.
Залитые аккумуляторы для тяжелых грузовиков
Наши аккумуляторы высокой мощности для коммерческого применения обеспечивают высочайшую производительность и увеличенный срок службы в циклах для самых сложных условий. Технология решетки PowerFrame® обеспечивает более длительный срок службы, устойчивость к коррозии и до 70 % лучшее прохождение тока.
Кроме того:
- Усиленные полюсные мостики и горячий компаунд на ушках пластин увеличивают устойчивость к вибрации.
- Встроенные складные ручки обеспечивают простую переноску и установку.
- Устойчивый к ударам корпус с усиленными торцевыми стенками для большей прочности.
- Прочные сепараторы предотвращают короткие замыкания.
— обзор
3 Свинцово-кислотные батареи
Свинцово-кислотные батареи существуют в качестве коммерческих продуктов более 100 лет и нашли применение в большом количестве различных систем. Наиболее заметное применение было в автомобильной промышленности для запуска двигателей внутреннего сгорания и для обеспечения энергией электрического оборудования в транспортных средствах, такого как фонари, окна и дисплеи. Эти батареи обычно называются батареями SLI (пусковые, осветительные и зажигательные) и способны обеспечивать высокие токи, необходимые для первоначального запуска двигателя.Другие приложения включают фотоэлектрические накопители энергии, резервные накопители энергии (в частности, для обеспечения резервного аварийного питания и бесперебойного питания стратегического оборудования, такого как освещение, телефон и системы связи), а также транспортные устройства, такие как подземные шахтные конвейеры, подводные лодки (особенно для бесшумного оборудования). маневренность в погружении), тележки для гольфа, грузовики для доставки молока и почты, а также небольшие автомобили и грузовики с электрическим приводом. Свинцово-кислотные аккумуляторы составляют примерно 40% от общего объема продаж аккумуляторов в мире, что можно объяснить их хорошо разработанной и надежной технологией и значительным преимуществом в стоимости.
3.1 Общая химия, конструкция и эксплуатация
Свинцово-кислотные батареи состоят из отрицательного металлического свинцового (Pb) электрода, положительного электрода из диоксида свинца (PbO 2 ) и сернокислотного электролита. Общая реакция ячейки:
Pb + PbO2 + 2h3SO4 → 2PbSO4 + 2h3O.
Напряжение свинцово-кислотных элементов в разомкнутой цепи примерно 2 В; Таким образом, стандартная батарея на 12 В (SLI) состоит из шести отдельных ячеек, соединенных последовательно. Во время разряда сульфат свинца (PbSO 4 ) образуется в виде электродов Pb и PbO 2 с водой (H 2 O) в качестве побочного продукта реакции.Поскольку удельный вес (SG) или плотность H 2 SO 4 заметно отличается от H 2 O, SG электролита можно удобно использовать для контроля состояния заряда элементов и батареи и для выявления «мертвых» клеток. Удельный вес свинцово-кислотных элементов зависит от типа конструкции батареи; Полностью заряженные элементы обычно имеют удельный вес около 1,3, тогда как удельный вес полностью разряженных элементов обычно составляет 1,2 или ниже.
Свинцово-кислотные батареи собираются в разряженном состоянии из электродов, которые производятся путем реакции PbO, Pb и серной кислоты с образованием «трехосновного» (3PbO · PbSO 4 ) и «четырехосновного» (4PbO · PbSO 4 ). ) соли, которые либо наклеиваются на плоские свинцовые сетки, либо уплотняются в пористые трубчатые электроды с центральным токосъемным стержнем, а затем отверждаются в контролируемых условиях влажности и температуры.Процесс образования (начального заряда) необходим для преобразования солей в Pb и PbO 2 на отрицательном и положительном электродах соответственно. Красный свинец (Pb 3 O 4 ), который обладает большей проводимостью, чем PbO, иногда добавляют к положительному электроду, чтобы способствовать образованию PbO 2 .
Поскольку Pb — мягкий металл (точка плавления 327 ° C), небольшие количества добавок, таких как сурьма, кальций и селен, были использованы для повышения устойчивости свинцовых решеток к нагрузкам.Сурьма, в частности, значительно увеличивает механическую прочность решеток, но также увеличивает их электрическое сопротивление. Дополнительным недостатком сурьмы является то, что во время зарядки может образовываться токсичный стибен (SbH 3 ), что исключает использование свинцово-кислотных аккумуляторов со свинцово-сурьмянистыми электродами в плохо вентилируемых зонах, например, при подземных горных работах и на подводных лодках.
Зарядка свинцово-кислотных аккумуляторов также может быть опасной. Напряжение свинцово-кислотных аккумуляторов (2 В) выше, чем требуется для электролиза воды, в результате чего во время зарядки аккумуляторов выделяются водород и кислород.Улучшения были сделаны с введением свинцово-кислотных («необслуживаемых») батарей с регулируемым клапаном, в которых выделяющийся кислород рекомбинируется со свинцом на отрицательном электроде и в которых выделяемый водород может быть минимизирован добавлением олова к свинцовые сетки, вентилируемые. Тем не менее, выделение водорода может представлять опасность для некоторых конструкций свинцово-кислотных аккумуляторов. Другой неизбежной и неотъемлемой опасностью свинцово-кислотных аккумуляторов является потенциальный риск утечки сернокислотного электролита, который является коррозионным и может вызвать серьезные химические ожоги.
3.2 Транспортные приложения
Несмотря на их относительно низкую удельную энергию, свинцово-кислотные батареи нашли широкое применение во многих транспортных средствах, как отмечалось ранее, где дальность полета транспортного средства не является первостепенной задачей. Недостатки, которые в конечном итоге будут иметь значение для свинцово-кислотных аккумуляторов для транспортных средств перед лицом новых альтернативных технологий, — это их относительно низкая удельная энергия и разрушение при длительном хранении, если они хранятся в разряженном состоянии.Тем не менее за последние несколько лет General Motors добилась больших успехов в разработке компактного электромобиля ограниченного производства, известного как EV1, который сейчас находится во втором поколении. Расчетный пробег составляет 55–95 миль, в зависимости от условий движения, что достигается за счет аэродинамической, легкой конструкции и рекуперативного торможения аккумуляторной батареи. Самое большое преимущество свинцово-кислотных аккумуляторов перед конкурентными технологиями — это стоимость; они в 10 раз дешевле современных никель-металлогидридных, литий-ионных и литий-полимерных аккумуляторов, которые разрабатываются для высокопроизводительных транспортных средств.
Что такое аккумуляторная кислота? | Блог химии
Аккумуляторная кислота обычно относится к кислоте, используемой в свинцово-кислотных аккумуляторах, хотя она необходима для функционирования любой кислотной аккумуляторной батареи или химического элемента. Хранение химической энергии для возможного использования в электричестве — это основной принцип, лежащий в основе батарей, в том числе батарей, использующих кислоту.
Принцип действия этого электрохимического процесса во многом обусловлен особой структурой и химическим составом этих устройств, но аккумуляторная кислота также играет решающую роль.
Связанный: Купить аккумуляторную кислоту онлайн Из чего сделана аккумуляторная кислота?Обычно относится к типу кислоты, используемой в перезаряжаемых свинцово-кислотных аккумуляторах, например, используемых в автомобилях, аккумуляторная кислота состоит из серной кислоты (H 2 SO 4 ), которая была разбавлена очищенной водой до концентрации около 30-50%. В этом контексте аккумуляторная кислота имеет кислотный pH 0,8. Вот почему с ним нужно обращаться осторожно.
Свинцово-кислотные батареи состоят из двух проводящих свинцовых пластин, называемых электродами, которые заполнены вязким гелеобразным веществом. Между этими пластинами находится разбавленный раствор серной кислоты, также известный как электролит. Другой ключевой частью свинцово-кислотных аккумуляторов является разделитель, который служит изолятором, предотвращая прямое соприкосновение двух пластин друг с другом, что может привести к короткому замыканию.
Аккумуляторная кислота — это серная кислота, разбавленная очищенной водой. Что делает аккумуляторная кислота?Проще говоря, аккумуляторная кислота способствует преобразованию накопленной химической энергии в электрическую.Обычная батарея обычно состоит из трех основных частей:
- Отрицательный электрод , также известный как анод , который отправляет электроны во внешнюю цепь. Обычно это делается из губчатого свинца
- Положительный электрод или катод , который принимает электроны от внешней цепи. Обычно это делается из диоксида свинца
- Электролит , который обеспечивает ионную проводимость .Обычно это жидкий раствор , растворителя и растворенных солей.
Электрохимическая реакция, обеспечиваемая кислотой аккумулятора, позволяет стабильному току проходить через пары электродов, когда электричество входит в анод и выходит из катода.
Когда батарея разряжается или используется в качестве источника питания, серная кислота в электролите реорганизует свои ионы так, чтобы они были менее концентрированными и более похожими на H 2 O.При этом выделяется серия сульфатов, которые покрывают свинцовые пластины анода и катода. Это уменьшает область, в которой могут происходить дальнейшие электрохимические реакции. Эта площадь поверхности, хотя и постоянно выделяет ионы, затем будет становиться все меньше и меньше по мере использования большего количества ионов.
Батарея будет продолжать работать до тех пор, пока не перестанет обеспечивать достаточную мощность из-за того, что в ее электролите отсутствуют сульфат-ионы. Чтобы снова заработать, аккумулятор необходимо перезарядить — процесс, который, по сути, является обратной реакцией того, что мы только что описали.
Вкратце, зарядка аккумулятора преобразует электрическую энергию в химическую энергию, а при использовании (или разрядке) аккумулятора используется накопленная химическая энергия, преобразовывая ее в электрическую энергию.
Почему батареи содержат кислоту?Батареи содержат кислоту, поскольку она играет ключевую роль в протекающей электрохимической реакции. Также называемый аккумуляторным электролитом, аккумуляторная кислота — это среда, которая переносит электрический ток между положительным и отрицательным электродами.
Однако, хотя для облегчения реакции аккумуляторным батареям необходим электролит, это не обязательно должен быть разбавленный раствор серной кислоты. Электролиты в батареях могут быть растворителями, смешанными с растворенными кислотами или щелочами, а типичные батареи AA / AAA / D даже содержат твердые, а не жидкие электролиты.
Насколько сильна батарея кислотная?Аккумуляторная кислота обычно имеет концентрацию около 15–35%, хотя ее крепость может достигать 50%.Любая концентрация серной кислоты в свинцово-кислотных аккумуляторах вызывает сильную коррозию. Неправильное обращение с этим химическим веществом может привести к необратимой слепоте, тяжелым ожогам, повреждению внутренних органов при проглатывании или даже смерти.
Аккумуляторная кислота также легко воспламеняется и может воспламениться при сильном нагреве или давлении. Наряду с этими особенностями стоит отметить уникальную химическую структуру аккумуляторной кислоты и то, как она вступает в реакцию с другими материалами, создавая электричество или накапливая химическую энергию.
Какова формула аккумуляторной кислоты?Аккумуляторная кислота не имеет определенной формулы, но обычно она состоит только из серной кислоты (H 2 SO 4 ) и воды (H 2 O) с приблизительным уровнем pH 0.8 при концентрации 4-5 моль / л.
Как работает батарея, электроны текут от отрицательно заряженной свинцовой пластины к положительно заряженной пластине из диоксида свинца. Это движение электронов приводит к тому, что сульфаты, высвобождаемые из аккумуляторной батареи, покрывают анод кислотой, которая высвобождает избыточные электроны в устройство и обратно на катод, тем самым облегчая электрический поток. Формула этой реакции:
Pb (с) + PbO 2 (с) + 2 H 2 SO 4 (водн.) → 2PbSO 4 (с) + 2H 2 O
Аккумуляторная кислота содержится в свинцово-кислотных аккумуляторах, которые обычно используются для питания отстойников в случае аварийного освещения. Что происходит при использовании батареи?Что на самом деле происходит, когда батарея используется, так это то, что отрицательно заряженные сульфат-ионы в кислоте батареи попадают на отрицательный электрод, т.е.е. анод. Здесь они высвобождают свой отрицательный заряд, в то время как остальные сульфат-ионы соединяются с электродом, образуя сульфат свинца. Этот процесс сменяется высвобождением избыточных электронов, выходящих из отрицательного электрода и обратно к положительному электроду, то есть катоду.
Это, однако, со временем снижает концентрацию электролита, поскольку в растворе кислоты образуется больше сульфата свинца и больше воды. Это происходит, когда водород отделяется от H 2 SO 4 и вступает в реакцию с диоксидом свинца на катоде, что увеличивает концентрацию воды, поскольку больше ионов SO 4 будет использоваться для покрытия электрода во время использования батареи. .Это будет происходить до тех пор, пока аккумуляторная кислота не станет все более и более разбавленной, что сделает ее менее способной к дальнейшим электрохимическим реакциям из-за недостатка ионов сульфата.
По сути, постоянное движение ионов — это то, что создает стабильный ток в батареях. Когда кислород в пластине диоксида свинца реагирует с ионами водорода с образованием воды, а отделенный сульфат реагирует с другой пластиной с образованием большего количества сульфата свинца, остается более разбавленный раствор серной кислоты, который можно перезарядить путем реверсирования процесса. я.е. подавая в него электричество и преобразовывая его в накопленную химическую энергию.
Эти электрохимические реакции в батареях были бы невозможны без аккумуляторной кислоты. Однако по мере развития технологий появляются разные типы аккумуляторов, и необходимость пересмотра технических аспектов работы обычных автомобильных аккумуляторов необходима, чтобы позволить новаторам создавать больше функций для аккумуляторов, с кислотой или без нее.
— обзор
14.3.2 Применение слоистых двойных гидроксидных / полимерных нанокомпозитов в батареях
Свинцово-кислотные батареи широко применяются в системах двигателей для обеспечения большого тока, необходимого для стартерных двигателей машин, из-за их способности обеспечивать большой импульсный ток при их низкой стоимости. Однако они вызывают серьезное загрязнение окружающей среды. Литиевые батареи по сравнению со свинцово-кислотными и никелевыми батареями демонстрируют преимущества длительного срока службы, высокой плотности энергии, экологической совместимости и высокого рабочего напряжения (Shao et al., 2015b). Литиевые батареи легкие, с рабочим напряжением ~ 3,6 В, удельной энергией от 100 Втч / кг до 150 Втч / кг и выходной емкостью от 700 до 2400 мА / ч для аккумулятора. Они широко используются в портативных электронных устройствах, таких как сотовые телефоны, ноутбуки и видеокамеры. Литиевые батареи обычно заряжаются и разряжаются при токе 0,2-1 ° C, что означает, что полная емкость элемента сохраняется или используется за 5 и 1 час соответственно. Обычный диапазон рабочих температур ( T ) литиевых батарей составляет 15 ° C-60 ° C.При T <15 ° C емкость становится низкой, тогда как при T > 60 ° C в течение определенного периода времени начинается медленная деградация материалов электрода / электролита (Reddy et al., 2013; Roy and Srivastava, 2015). Однако батареи с большей плотностью энергии и более продолжительным жизненным циклом для расширения новых электронных систем имеют важное значение.
Полимерные электролиты безвредны для окружающей среды, их различные применения показывают хорошую ионную проводимость, превосходные механические свойства и соответствие электрохимическим характеристикам (Nicotera et al., 2015; Ляо и Е, 2004а). Они играют важную роль в развитии литий-полимерных аккумуляторных батарей, поскольку могут привести к гибкой расслоенной структуре с нестандартной геометрией. Твердотельные электролитные системы полиэтиленоксида (PEO) / LDH NC обладают высокой ионной проводимостью и могут использоваться для изготовления литий-полимерных вторичных батарей (Liao and Ye, 2003, 2004a, b).
Батареи на основе литий-серы (Li-S) были заявлены как хорошие кандидаты для новых устройств накопления энергии.Li-S батареи имеют много преимуществ, таких как недорогой материал, высокая безопасность и высокая плотность энергии. Поэтому в последнее время их рассматривают как наиболее многообещающую альтернативу литиевым батареям во многих приложениях, от электромобилей до стационарных сетевых хранилищ. Однако этим батареям в значительной степени препятствуют определенные проблемы, особенно низкое использование серы и быстрое истощение емкости из-за растворения промежуточного продукта разряда, полисульфида, и его диффузии через сепаратор к анодной стороне (Zhou et al., 2017б). Основная проблема для Li – S батарей — это предотвращение растворения полисульфидов при сохранении высокого уровня использования серы. Таким образом, Zhang et al. (2016) изготовили новый тип наноклеток с двойной оболочкой с внутренней оболочкой из гидроксида кобальта [Co (OH) 2 ] и внешней оболочкой из LDH ([электронная почта защищена]) в качестве нового серного хозяина для Li – S аккумуляторов ( Рис. 14.7). Катод из этого композита имеет множество преимуществ. В частности, композит [защищенный по электронной почте] / S загружен 75 мас.% Серы, а наноклетки с двойной оболочкой из [защищенного по электронной почте] готовят несколько отличные функциональные поверхности для химической связи с полисульфидами, чтобы предотвратить их растворение.Композит [защищенный по электронной почте] / S был исследован в качестве катодного материала для Li-S аккумуляторов и продемонстрировал значительно улучшенные электрохимические характеристики и был способен сохранять высокую циклическую стабильность при 0,1 и 0,5 ° C выше 100 циклов, а также обеспечивал большую емкость с отличным концентрация серы 3 мг / см 2 . В другой работе Zhou et al. (2017b) сообщили об использовании листов LDH в качестве модифицирующего слоя на полипропиленовом сепараторе, синергетически действующего как барьер физического удержания, так и химическая ловушка, которая эффективно блокирует переход полисульфида и, соответственно, увеличивает срок службы Li-S батарей.Результаты показали, что с листами LDH, блокирующими переход полисульфида, ухудшение рабочих характеристик, очевидно, улучшилось: от 0,29% за цикл для чистого сепаратора до 0,18% за цикл для модифицированного сепаратора. Успешное внедрение листов LDH с положительным зарядом для модификации сепаратора в Li – S батарее откроет новое окно для будущего развития в разработке высокоэффективных Li – S батарей.
Рисунок 14.7. (A) Схематическое изображение синтеза композита [email protected] / S.(B) SEM и TEM изображения (a, e) ZIF-67, (b, f) однослойные [защищенные по электронной почте], (c, g) двухслойные [защищенные по электронной почте] наноклетки и (d, h) [электронная почта защищена] / S.
Источник: По материалам Zhang, J., Hu, H., Li, Z., Lou, XWD, 2016. Двухслойные наноклетки с внутренней оболочкой из гидроксида кобальта и многослойной внешней оболочкой из двойных гидроксидов в качестве высокоэффективного полисульфидного медиатора для литий-серные батареи. Энгью. Chem. Int. Изд., 55 (12), 3982–3986. С любезного разрешения Wiley.Среди перезаряжаемых батарей, несмотря на то, что литий-ионные батареи имеют высокую плотность энергии, они дороги и имеют некоторые проблемы с безопасностью из-за воспламеняемости, что накладывает ограничения на их разнообразные приложения для хранения энергии (Yan and Yang, 2016; Huang et al., 2015). Цинковые электроды в качестве анодных веществ для щелочных вторичных батарей были предложены для нового поколения источников энергии, используемых в электромобилях в последние годы. Это связано с их превосходными электрохимическими характеристиками, такими как хорошее напряжение холостого хода, большой удельной энергией, а также дешевизна и экологичность. Однако из-за дефектов цинкового электрода, таких как изменение формы, рост дендритов, неактивная поверхность и саморазряд цинка, разработка Ni-Zn вторичных батарей ограничена их малым сроком службы.Эти дефекты в основном вызваны высокой растворимостью цинк-активных материалов в щелочных электролитах. Следовательно, различные добавки, такие как Bi (III) (Zhang et al., 2015c), In (III) (Wang et al., 2014b), цинкаты кальция (Wang et al., 2014a), полианилин (Huang et al. , 2014a) и полипиррол (Huang et al., 2014b) были добавлены в цинковые электроды, чтобы преодолеть эти проблемы (Huang et al., 2015). В последнее время СДГ и их материалы были изучены как новый тип электрода во вторичных батареях Ni – Zn.Ян и Ян (2016) успешно синтезировали композиты Zn-Al-LDH / PPY путем полимеризации пиррола в суспензии гидроталькита при обработке ультразвуком и перемешивании с целью объединения достоинств LDH и PPY для достижения отличных электрохимических характеристик. Они оценили электрохимические характеристики композитов Zn-Al-LDH / PPY в качестве электрода для аккумуляторной батареи Ni-Zn. Результаты показали лучшую обратимость и превосходную стабильность цикла по сравнению с чистым электродом из LDH. Кроме того, результаты теста EIS показали, что модификация PPY снижает сопротивление переносу заряда электрода и улучшает проводимость анода, что значительно повышает электрохимические характеристики композитов Zn-Al-LDH / PPY.
Уголок вопроса: Аккумуляторная кислота — The Hindu
Почему в батареях используется только серная кислота? Почему не соляная кислота или азотная кислота?
ПРИЯНУЙ
Хокраджар, Ассам
Электрохимические реакции составляют основу преобразования химической энергии в электрическую в батареях. Электрохимическая реакция — это окислительно-восстановительная реакция, в которой участвующие электроны хитроумно направляются через внешнюю цепь, где они совершают полезную работу.
Во время разряда батареи электроны, высвобождаемые на отрицательном электроде (катоде), проходят через внешнюю цепь и достигают положительного электрода (анода). Нейтральность заряда внутри батареи устанавливается движением ионов в электролите.
Таким образом, электролит должен хорошо проводить ионы. Электролит в батарее может участвовать или не участвовать в реакциях, протекающих на электродах, но должен поддерживать реакции. Например, электролит не участвует в клеточных реакциях в никель-кадмиевых и литий-ионных батареях.
В случае сухих элементов из цинка и диоксида марганца можно использовать различные нейтральные / щелочные электролиты, такие как хлорид аммония, хлорид цинка и гидроксид калия.
В зависимости от используемых химикатов, цинк-марганцевый элемент с электролитом гидроксида калия может быть выполнен в виде первичного или вторичного элемента.
Работа свинцово-кислотной аккумуляторной батареи (обычно используемой для запуска-зажигания-зажигания в автомобилях) включает образование сульфата свинца за счет окисления свинца на аноде и восстановления диоксида свинца на катоде.
Поскольку продуктом разряда батареи является сульфат свинца на обоих электродах, общую реакцию в элементе иногда называют реакцией двойного сульфата.
В образовании продуктов сульфата свинца участвует серная кислота, которая является электролитом, используемым в этих батареях. Во время зарядки аккумулятора сульфат свинца снова превращается в свинец и диоксид свинца, выделяя серную кислоту в электролит.
Поскольку серная кислота расходуется во время процесса разряда и высвобождается во время процесса заряда, удельный вес электролита изменяется во время использования и зарядки аккумулятора.
Следовательно, удельный вес электролита используется как индикатор степени заряда свинцово-кислотных аккумуляторов. Поскольку основные реакции в батарее включают поглощение и высвобождение молекул серной кислоты, в этих батареях используется электролит серной кислоты.
Однако возможно использование других электролитов с парой свинец-диоксид свинца. Они включают хлорную кислоту, фторборную кислоту, кремнефтористоводородную кислоту и т. Д. Но проблемы с их использованием ограничивают их применимость в качестве электролитов.Например, хлорная кислота потенциально взрывоопасна при контакте с органическими веществами.
Т. ШРИ ДЭВИ КУМАРИ
CSIR-старший научный сотрудник
Отдел функциональных материалов
ЦНИИ-ЦНИИ
Караикуди, Тамил Наду
(копия исправлена за фактическую ошибку)
Статьи оBatteryStuff | Объяснение свинцово-кислотной батареи
Стю Олтман — технический редактор журнала Wing World Magazine
Отредактировано и перепечатано с разрешения
Аккумулятор для мотоциклов на 12 В состоит из пластикового корпуса, содержащего шесть ячеек.Каждая ячейка состоит из набора положительных и отрицательных пластин, погруженных в разбавленный раствор серной кислоты, известный как электролит, и каждая ячейка имеет напряжение около 2,1 В при полной зарядке. Шесть элементов соединены вместе, чтобы получить полностью заряженную батарею примерно на 12,6 вольт.
Это здорово, но как вливание свинцовых пластин в серную кислоту производит электричество? Батарея использует электрохимическую реакцию для преобразования химической энергии в электрическую. Давайте посмотрим.Каждая ячейка содержит пластины, напоминающие крошечные квадратные теннисные ракетки, сделанные либо из свинцовой сурьмы, либо из свинцово-кальциевого сплава. Затем к пластинам приклеивается паста из так называемого «активного материала»; губчатый свинец для отрицательных пластин и диоксид свинца для положительных. В этом активном материале происходит химическая реакция с серной кислотой, когда на клеммы батареи подается электрическая нагрузка.
Как это работает
Позвольте мне сначала дать вам общую картину для тех, кто не очень ориентирован на детали.В основном, когда батарея разряжается, серная кислота в электролите истощается, так что электролит больше напоминает воду. В то же время сульфат кислоты покрывает пластины и уменьшает площадь поверхности, на которой может происходить химическая реакция. Зарядка обращает процесс, возвращая сульфат обратно в кислоту. Это вкратце, но читайте дальше, чтобы лучше понять. Если вы уже бежали из комнаты, крича и волоча за волосы, не волнуйтесь.
Электролит (серная кислота и вода) содержит заряженные ионы сульфата и водорода. Ионы сульфата заряжены отрицательно, а ионы водорода — положительно. Вот что происходит при включении нагрузки (фары, стартера и т. Д.). Ионы сульфата перемещаются к отрицательным пластинам и теряют свой отрицательный заряд. Оставшийся сульфат соединяется с активным материалом на пластинах с образованием сульфата свинца. Это снижает прочность электролита, а сульфат на пластинах действует как электрический изолятор.Избыточные электроны уходят с отрицательной стороны батареи через электрическое устройство и обратно к положительной стороне батареи. На положительном выводе батареи электроны устремляются обратно и принимаются положительными пластинами. Кислород в активном материале (диоксид свинца) реагирует с ионами водорода с образованием воды, а свинец реагирует с серной кислотой с образованием сульфата свинца.
Ионы, движущиеся в электролите, создают ток, но по мере того, как элемент разряжается, количество ионов в электролите уменьшается, и площадь активного материала, доступного для их приема, также уменьшается, поскольку он покрывается сульфатом.Помните, что химическая реакция происходит в порах активного материала, прикрепленного к пластинам.
Многие из вас, возможно, заметили, что аккумулятор, используемый для запуска велосипеда, который просто не заводится, быстро достигает точки, в которой даже двигатель не заводится. Однако, если эту батарею оставить на некоторое время, она, кажется, оживает. С другой стороны, если вы оставите переключатель в положении «парк» на ночь (горят только пара маленьких лампочек), аккумулятор будет совершенно бесполезен утром, и никакое количество отдыха не приведет к его восстановлению.Почему это? Поскольку ток возникает в результате химической реакции на поверхности пластин, сильный ток быстро восстанавливает электролит на поверхности пластин до воды. Напряжение и ток будут снижены до уровня, недостаточного для работы стартера. Требуется время, чтобы большее количество кислоты диффундировало через электролит и попало на поверхность пластин. Это достигается за счет короткого периода отдыха. Кислота не истощается так быстро, когда ток небольшой (например, для питания лампы заднего фонаря), а скорость диффузии достаточна для поддержания напряжения и тока.Это хорошо, но когда напряжение в конечном итоге падает, кислота больше не прячется за пределами ячейки, чтобы мигрировать к пластинам. Электролит в основном состоит из воды, а пластины покрыты изолирующим слоем из сульфата свинца. Теперь требуется зарядка.
Саморазряд
Одна не самая приятная особенность свинцово-кислотных аккумуляторов заключается в том, что они разряжаются сами по себе, даже если не используются. Общее практическое правило — норма саморазряда один процент в день.Эта скорость увеличивается при высоких температурах и уменьшается при низких температурах. Не забывайте, что ваше Gold Wing с часами, стереосистемой и радио CB никогда не выключается полностью. Каждое из этих устройств имеет «поддерживающую память», чтобы сохранить ваши предварительные настройки радио и время, и эти воспоминания потребляют около 20 миллиампер, или 0,020 ампер. Это будет высасывать из вашей батареи около получаса в день при температуре 80 градусов по Фаренгейту. Эта тяга, в сочетании со скоростью саморазряда, разряжает вашу батарею на 50 процентов за две недели, если велосипед оставить без присмотра и без седла.
Когда аккумулятор заряжается
Зарядка — это процесс, обращающий электрохимическую реакцию в обратном направлении. Он преобразует электрическую энергию зарядного устройства в химическую энергию. Помните, батарея не накапливает электричество; в нем хранится химическая энергия, необходимая для производства электроэнергии.
Зарядное устройство для аккумулятора меняет направление тока, при условии, что зарядное устройство имеет большее напряжение, чем аккумулятор. Зарядное устройство создает избыток электронов на отрицательных пластинах, и положительные ионы водорода притягиваются к ним.Водород реагирует с сульфатом свинца с образованием серной кислоты и свинца, и когда большая часть сульфата уходит, водород поднимается с отрицательных пластин. Кислород в воде реагирует с сульфатом свинца на положительных пластинах, снова превращая их в диоксид свинца, и пузырьки кислорода поднимаются от положительных пластин, когда реакция почти завершается.
Многие люди думают, что внутреннее сопротивление аккумулятора велико, когда аккумулятор полностью заряжен, но это не так. Если вы задумаетесь, то вспомните, что сульфат свинца действует как изолятор.Чем больше сульфата на пластинах, тем выше внутреннее сопротивление аккумулятора. Более высокое сопротивление разряженной батареи позволяет ей принимать более высокую скорость заряда без выделения газов или перегрева, чем когда батарея почти полностью заряжена. Почти полностью заряжен, остается не так много сульфата, чтобы поддерживать обратную химическую реакцию. Уровень зарядного тока, который может применяться без перегрева батареи или разрушения электролита на водород и кислород, известен как «естественная скорость поглощения батареи».«Когда зарядный ток превышает эту естественную скорость поглощения, происходит перезарядка. Аккумулятор может перегреться, и электролит будет пузыриться. На самом деле, часть зарядного тока тратится в виде тепла даже при правильных уровнях зарядки, и эта неэффективность создает необходимость чтобы вернуть в аккумулятор больше ампер-часов, чем было извлечено. Подробнее об этом позже.
Как долго прослужит моя батарея?
Есть много вещей, которые могут привести к выходу аккумулятора из строя или резко сократить срок его службы.Одна из этих вещей позволяет батарее оставаться в частично разряженном состоянии . Мы говорили о том, что сульфат образуется на поверхности пластин аккумулятора при разряде, а также сульфат образуется в результате саморазряда. Сульфат также быстро образуется, если уровень электролита упадет до точки, при которой пластины будут обнажены. Если позволить этому сульфату оставаться на пластинах, кристаллы станут больше и затвердеют до тех пор, пока их невозможно будет удалить загрузкой.Следовательно, количество доступной площади поверхности для химической реакции будет постоянно уменьшаться. Это состояние известно как «сульфатирование», и оно необратимо снижает емкость аккумулятора. Батарея на 20 ампер в час может начать работать как батарея на 16 ампер в час (или меньше), быстро теряя напряжение под нагрузкой и не в состоянии поддерживать напряжение, достаточное во время запуска, для работы системы зажигания велосипеда. Это последнее условие очевидно, когда двигатель отказывается запускаться, пока вы не уберете палец с кнопки запуска.Когда вы отпускаете стартер, напряжение аккумулятора мгновенно подскакивает до достаточного уровня. Поскольку двигатель все еще кратковременно вращается, при включенном зажигании зажигаются свечи зажигания. В следующей статье мы увидим, почему повышенное внутреннее сопротивление из-за сульфатирования приводит к снижению мощности, подаваемой на стартер.
Глубокая разрядка — еще один убийца батареи. Каждый раз, когда батарея глубоко разряжается, часть активного материала падает с пластин на дно батарейного отсека.Естественно, остается меньше материала для проведения химической реакции. Если на дне корпуса скапливается достаточно этого материала, пластины могут замкнуться вместе и вывести аккумулятор из строя.
Перезарядка — коварный убийца; его эффекты часто не очевидны для невиновного покупателя капельного зарядного устройства за десять долларов, который оставляет его подключенным к батарее на длительные периоды времени. Https://www.batterystuff.com/battery-chargers/#mce_temp_url# заряжается с постоянной скоростью независимо от уровня заряда аккумулятора.Если эта скорость превышает естественную скорость поглощения батареи при полной зарядке, электролит начнет разрушаться и выкипать. Многие гонщики всю зиму хранят велосипед на зарядном устройстве, а весной обнаруживают, что аккумулятор практически разряжен. Кроме того, поскольку зарядка имеет тенденцию окислять положительные пластины, продолжающаяся перезарядка может привести к коррозии пластин или разъемов, пока они не ослабнут и не сломаются.
Недостаточная зарядка — это состояние, которое встречается на многих мотоциклах. Ваш регулятор напряжения настроен на поддержание напряжения вашей системы на уровне от 14 до 14.4 вольта. Если вы один из тех, кто ездит по автомагистралям между штатами, а ваш вольтметр показывает только 13,5 вольт, потому что вы сжигаете больше огней, чем рождественский дисплей Macy, вы должны знать, что этого напряжения достаточно для поддержания заряженной батареи, но недостаточно для полного заряда. перезарядить разряженный.
Помните, мы говорили, что газовыделение происходит, когда весь или большая часть сульфата свинца превращается обратно в свинец и диоксид свинца. Напряжение, при котором это обычно происходит, известное как напряжение газовыделения, обычно чуть выше 14 вольт.Если напряжение в вашей системе никогда не будет таким высоким, и если вы никогда не компенсируете это путем подключения к зарядному устройству дома, сульфат начнет накапливаться и затвердевать, как налет во рту. Считайте, что периодическая тщательная зарядка — это как хорошая чистка зубов зубной нитью и зубной нитью. Если вы не соблюдаете гигиену полости рта, вы можете пойти к дантисту и попросить его взорвать и поскрести всю эту мерзость. Когда ваша батарея достигает этой стадии, это занавески!
Какой тип зарядного устройства и почему
Ваш генератор переменного тока и стандартное автомобильное зарядное устройство имеют много общего; они стремятся поддерживать постоянное напряжение.Вот проблема с попыткой быстро зарядить сильно разряженный аккумулятор любым из них. Помните, мы обсуждали, как при сильном потреблении тока батарея выглядит разряженной. Затем, когда кислота диффундирует через элементы, концентрация на поверхности пластин увеличится, и батарея вернется к жизни.
Аналогичным образом напряжение аккумулятора во время заряда увеличивается из-за концентрации кислоты, которая возникает на поверхности пластин. Если скорость заряда значительная, напряжение будет быстро расти.Конусное зарядное устройство или автомобильный регулятор напряжения резко снизят скорость заряда, когда напряжение поднимется выше 13,5, но соизмеримо ли состояние заряда аккумулятора с напряжением? Нет! Опять же, требуется время, чтобы кислота распространилась по клеткам.
Несмотря на то, что напряжение может быть высоким, электролит на внешней стороне элементов все еще слаб, и батарея может быть на гораздо более низком уровне заряда, чем может указывать напряжение. Только после продолжительной зарядки при пониженном токе будет достигнута полная емкость.По этой причине вы не должны судить о состоянии заряда аккумулятора, измеряя напряжение во время зарядки. Проверяйте его только после того, как дайте батарее посидеть хотя бы час. Напряжение будет снижаться и стабилизироваться по мере того, как кислота диффундирует по клеткам.
За последние несколько лет несколько компаний разработали зарядные устройства, которые могут быстро заряжать разряженную батарею, а затем удерживать батарею под напряжением, которое не вызывает ее газообразования и не допускает саморазряда. Их иногда называют «умными зарядными устройствами» или многоступенчатыми зарядными устройствами.Вот как они работают.
Мы сказали, что аккумулятор может принимать гораздо более высокую скорость заряда, когда он частично разряжен, чем когда он почти полностью заряжен. Эти многоступенчатые зарядные устройства используют этот факт, начиная заряд с постоянным током или в режиме «объемной зарядки». Обычно они обеспечивают заряд от 650 мА до 1,5 А, в зависимости от марки и модели. Этот объемный заряд поддерживается постоянным (или должен быть) до тех пор, пока напряжение аккумулятора не достигнет 13,5 В, что позволяет аккумулятору поглотить большее количество заряда за короткое время и без повреждений.Затем зарядное устройство переключается на постоянное напряжение или «абсорбционный» заряд.
Идея состоит в том, чтобы позволить батарее поглотить последние 15 процентов своего заряда с естественной скоростью поглощения, чтобы предотвратить чрезмерное выделение газов или нагрев. Наконец, эти зарядные устройства переключаются в «плавающий» режим, в котором напряжение аккумулятора поддерживается на уровне, достаточном для предотвращения разрядки, но недостаточном для возникновения перезарядки. Различные компании в целом расходятся во мнениях относительно того, каким должно быть это напряжение холостого хода, но обычно оно составляет 13.2 и 13,4 вольт. Фактически, плавающее напряжение должно иметь температурную компенсацию от 13,1 вольт при 90 градусах по Фаренгейту до 13,9 вольт при 50 градусах. Большинство очень дорогих многоступенчатых зарядных устройств большой мощности для использования с более крупными батареями RV имеют температурную компенсацию, но, насколько мне известно, ни один из мотоциклов не поддерживает; они используют компромиссную настройку с плавающей запятой.
Итак, я могу просто установить и забыть, верно? Не совсем так. Во-первых, вам нужно время от времени проверять уровень жидкости в аккумуляторе (если у вас нет герметичного аккумулятора).Еще одна проблема — это проба батареи. Даже если его удерживать на уровне 13 вольт, постоянное напряжение позволит аккумулятору со временем начать сульфатироваться. Для большинства этих устройств я рекомендую отключать зарядное устройство от сети не реже одного раза в 60 дней во время сезонного хранения. Дайте батарее отдохнуть пару дней, а затем снова подключите зарядное устройство.
Все еще здесь?
Если вы все еще читаете это, значит, вы настоящий солдат. Я понимаю, что эта тема может сбивать с толку или даже скучать, но наберись духа; Я легкомысленно относился к тебе.Остается гораздо больше невысказанного, чем то, что здесь показано. Это были «Лучшие хиты Battery». Я надеюсь, что этого было достаточно, чтобы заинтересовать вас, не отправляя вас в информационную перегрузку, и, возможно, теперь, когда вы знаете, сколько способов сократить срок службы батареи, вы знаете, почему никто не может предсказать, как долго прослужит батарея. Многие райдеры, которые считают, что отлично заботятся о своих батареях, на самом деле убивают их добротой.
Выберите зарядное устройство для аккумулятора
Была ли эта информация полезной? Подпишитесь, чтобы получать обновления и предложения.
Как ухаживать за свинцово-кислотными аккумуляторами
Знаете ли вы основную причину выхода свинцово-кислотных аккумуляторов из строя и потери емкости? Сульфатирование аккумулятора. Это причина этих проблем в 80% случаев. Но с правильными инструментами для обслуживания аккумуляторов и небольшими затратами времени вы вернете свои аккумуляторы к жизни и обеспечите их надежную работу. Узнайте все, что вам нужно знать об обслуживании аккумуляторных батарей.
Стартерные батареи, полутяговые батареи, тяговые батареи и даже стационарные батареи — все они нуждаются в техническом обслуживании, чтобы полностью раскрыть свой потенциал.Регулярно выполняйте три основные задачи по техническому обслуживанию, которые мы описываем здесь, чтобы оптимизировать производительность и надежность ваших свинцово-кислотных аккумуляторов.
Добавьте дистиллированную воду в свинцово-кислотную батарею
Жидкость в свинцово-кислотном аккумуляторе называется электролитом. На самом деле это смесь серной кислоты и воды. Когда аккумулятор заряжается, электролит нагревается, и часть воды испаряется. Во время процесса, называемого электролизом, вода распадается на газообразные водород и кислород, которые рассеиваются.Результат? Уровень электролита в аккумуляторе со временем понижается.
Если уровень электролита слишком низкий, пластины аккумуляторных элементов обнажатся и будут повреждены. Кроме того, серная кислота будет более концентрированной. Это означает, что вам необходимо заменить электролит. Вот как вы это делаете.
1. Проверить уровень воды в аккумуляторе с помощью индикатора уровня
Как узнать, когда нужно долить воду в аккумулятор? Это один из самых частых вопросов, которые нам задают.Вы можете постоянно проверять свою батарею или каждую батарею в каждой машине в вашем парке, но это ужасно много времени, и есть более простые подходы. Индикаторы специально разработаны для проверки уровня воды в аккумуляторе. Они уведомят вас, когда вам нужно зарядить аккумулятор.
Доступны разные системы. Один из них — Smartblinky. Вы устанавливаете его за вилкой аккумулятора. Есть ли зеленый свет? Ваш уровень электролита в порядке. Когда индикатор загорится красным, значит, пора добавить воды в аккумуляторные батареи.
Вы добавляете воду в аккумулятор до или после зарядки? Перед зарядкой всегда убедитесь, что электролит покрывает пластины аккумулятора. Если пластины закрыты, зарядите аккумулятор, а затем долейте его при необходимости. Это связано с тем, что электролит расширяется во время зарядки и, скорее всего, выльется через край, если вы уже долили его перед зарядкой.
2. Убедитесь, что у вас всегда под рукой есть дистиллированная вода.
Никогда не заливайте в аккумулятор обычную воду. Это повредит вашу батарею.Вам нужно использовать дистиллированную воду. Она также известна как деионизированная вода и деминерализованная вода. В основном это вода, прошедшая фильтрацию для удаления металлов и минералов, которые могут мешать процессам в вашей батарее.
Купите дистиллированную воду в строительном магазине или у специалиста по автомобильным запчастям. Также легко сделать самому. Вам понадобится простая водопроводная вода и устройство для деминерализации, такое как Hydropure. Самые простые из этих устройств заполнены смолой. Вы впускаете водопроводную воду, смола отфильтровывает металлы и минералы из воды, и у вас остается деионизированная, деминерализованная, дистиллированная вода, которая подходит для использования с вашей батареей.
3. Установить автоматическую систему доливки воды в аккумуляторную батарею
.Сколько дистиллированной воды вы добавляете в аккумулятор? Это еще один вопрос, который нам часто задают. Ответ варьируется от одной батареи к другой. Это одна из причин, по которой мы рекомендуем использовать систему наполнения аккумулятора водой.
В системе заливки воды в аккумуляторной батарее используются крышки заливных горловин с поплавками, которые соединяются друг с другом с помощью водяных шлангов. Они предохраняют аккумулятор от переполнения. И они экономят ваше время. Все, что вам нужно сделать, это налить в шланг дистиллированную воду.Все остальное сделает система розлива.
Свинцово-кислотная батарея выравнивания
Вторая задача при обслуживании аккумулятора — зарядка. Очень важно, чтобы вы заряжали аккумуляторные батареи равномерно.
Чем больше вы используете аккумулятор, тем больше может колебаться емкость разных элементов. Одна ячейка может быть полностью заряжена, а другая — наполовину. В этом случае аккумулятор не будет заряжаться полностью.
Мы советуем использовать уравнительное зарядное устройство для выравнивающего заряда.Выравнивание заряда батареи — это простой процесс, который предотвращает это. Зарядное устройство для аккумулятора обеспечивает более низкий ток в течение более длительного периода времени. В то время как типичный цикл зарядки длится около восьми часов, стабилизация занимает около одиннадцати часов. Поскольку он также требует более длительного времени охлаждения, чем обычный цикл зарядки, лучше всего выполнять выравнивающий заряд на выходных, чтобы у вас было достаточно времени для зарядки и охлаждения аккумулятора перед тем, как снова использовать его.
Что делать, если ваша батарея уже страдает от сульфатации? К счастью, сульфатирование можно контролировать и даже уменьшать.Просто пошлите через батарею большие кратковременные токи. Этот процесс называется восстановлением аккумуляторной батареи.
Держите аккумулятор в чистоте
И последнее, но не менее важное: очень важно содержать аккумулятор в чистоте.
Кислота аккумулятора, грязь и пыль — все известно, что они вызывают токи утечки, которые вызывают разряд аккумулятора и выходят из равновесия. Чистая батарея необходима. Как лучше это сделать? Используйте пароочиститель для аккумуляторов, например AQ steam или AQ steam pro.
У вас есть вопросы по любой из этих задач по обслуживанию аккумуляторных батарей? Вы хотите знать, какие продукты лучше всего подходят для обслуживания свинцово-кислотных аккумуляторов? Вы найдете ответы — и все остальное, что вам нужно знать — в нашем профессиональном руководстве по обслуживанию аккумуляторов. Нажмите на кнопку, чтобы посмотреть его в Интернете.
Загрузите нашу инструкцию по обслуживанию аккумуляторной батареи
У вас должен быть включен JavaScript, чтобы использовать эту форму.
Полив свинцово-кислотной батареи: основы
Точно так же, как вы не можете обойтись без воды, так же как и ваша батарея.Полив свинцово-кислотного аккумулятора — важный этап обслуживания, который нельзя пропустить. Он сохраняет вашу батарею в оптимальном состоянии и в безопасности. Несвоевременный полив свинцово-кислотной батареи может привести к серьезным повреждениям, но не всегда легко понять, когда лучше полить батарею. Следуйте этим инструкциям по поливу свинцово-кислотной батареи.
Почему батареи нужно поливать
Свинцово-кислотные батареи состоят из плоских свинцовых пластин, погруженных в бассейн с электролитом.Электролит состоит из воды и серной кислоты. Размер пластин аккумулятора и количество электролита определяют количество заряда, которое может сохранить свинцово-кислотный аккумулятор, или количество часов использования. Вода — ключевая часть функционирования свинцовой батареи.
Кроме того, во время процесса перезарядки, когда электричество проходит через водную часть электролита, вода превращается в свои исходные элементы, водород и кислород. Эти газы очень легковоспламеняющиеся, и поэтому из вашего жилого автофургона или морских аккумуляторов необходимо выпускать воздух наружу.Выделение газов приводит к потере воды, поэтому в свинцово-кислотные батареи необходимо периодически добавлять воду. Батареи, не требующие особого обслуживания, такие как батареи AGM, являются исключением, поскольку они способны компенсировать потерю воды.
Чрезмерный полив и недостаточный полив могут повредить аккумулятор. Чтобы свинцовый аккумулятор работал на максимальном уровне, следуйте этим рекомендациям по поливу.
Первое — Начните с безопасностиДля начала обязательно используйте средства индивидуальной защиты, такие как защитные очки и перчатки, при работе с аккумуляторами.Кроме того, очень важно понимать, что некоторые батареи требуют регулярного полива, в то время как другие батареи не требуют обслуживания.
Обязательно найдите информацию на этикетке аккумулятора, которая указывает, можно ли открыть аккумулятор и отремонтировать. В зависимости от типа батареи, которую вы используете, предупреждающие надписи на вашей батарее должны направлять вас «НЕ ОТКРЫВАТЬ» батарею или «ДЕРЖАТЬ ПРОВОДНУЮ КОЛПАЧКУ ПОСЛЕ ПОЛИВА». Обязательно следуйте инструкциям на этикетке с предупреждением.
Как полить аккумулятор
Хотя аккумулятор следует заправлять только после того, как он полностью зарядится, вам также следует проверить уровень воды перед зарядкой, чтобы убедиться, что воды достаточно, чтобы покрыть все открытые пластины. После зарядки добавьте достаточно воды, чтобы довести уровень до дна вентиляционного отверстия, примерно на ¾ ниже верха элемента.
Важно отметить, что владельцы аккумуляторов никогда не должны добавлять в аккумуляторы серную кислоту. При нормальной работе батареи потребляют только воду, а не серную кислоту.Когда уровень электролита в аккумуляторе низкий, наполнение аккумулятора водой сохранит аккумулятор здоровым и безопасным для использования.
Не над водойВо время зарядки аккумулятора плотность раствора электролита увеличивается. Если перед зарядкой было добавлено слишком много воды, уровень электролита увеличится, что приведет к переполнению аккумулятора и повреждению аккумулятора. Кроме того, чрезмерное увлажнение аккумулятора может привести к дополнительному разбавлению электролита, что приведет к снижению производительности аккумулятора.
Когда следует поливать аккумулятор?
Как часто вы добавляете воду в аккумулятор, зависит от того, как часто вы его используете. Аккумулятор для тележки для гольфа, который используется только по выходным, может потребовать полива только один раз в месяц. Вилочный погрузчик, который используется весь день, каждый день, может нуждаться в поливе аккумулятора каждую неделю. В жаркую погоду увеличивается потребность в поливе. Важно регулярно проверять уровень жидкости в аккумуляторе — лучше всего делать это после того, как аккумулятор полностью зарядится.
Какую воду использоватьИзбегайте использования водопроводной воды. При заправке аккумулятора обычная водопроводная вода не справится. Водопроводная вода содержит минералы, которые вредны для аккумуляторов, даже если их добавляют в небольших количествах. Это особенно верно для воды, умягченной с помощью умягчителей, содержащих хлориды. На всякий случай лучше всего подойдет дистиллированная вода, которая требует гораздо меньших вложений, чем новая батарея.
Помните, что вода будет находиться поверх раствора кислоты в вашей батарее, пока он не смешается с пузырьками, возникающими при зарядке.Если вы снимаете показания ареометра электролита, лучше всего снимать их после завершения зарядки.
Не допускайте обезвоживания аккумулятора. Поливайте в жаркие месяцы и круглый год.

